Москва, 2013 год
Рабочая группа по подготовке текста рекомендаций:
академик РАМН Шляхто Е.В. (Санкт-Петербург), профессор Арутюнов Г.П. (Москва), академик РАМН и член-корреспондент РАН Беленков Ю.Н. (Москва)
Председатель комитета экспертов:
профессор Ардашев А.В. (Москва)
Состав комитета экспертов по разработке рекомендаций:
профессор Аверьянов А.В. (Москва); профессор Бойцов С.А.(Москва); профессор Болдуева С.А. (Санкт-Петербург); профессор Борисов И.А. (Москва); к.м.н. Бутаев Т.Д. (Санкт-Петербург); к.м.н. Волков Д.Е. (Харьков); к.м.н. Гарькина С.В. (Самара); д.м.н Гринева Е.Н. (Санкт-Петербург); к.м.н. Думпис Я.Ю. (Санкт-Петербург); д.м.н. Дупляков Д.В. (Самара); к.м.н. Желяков Е.Г. (Москва); профессор Заклязьминская Е.В. (Москва); профессор Затейщиков Д.А. (Москва); к.м.н. Калинкин А.Л. (Москва); д.м.н. Карпенко Ю.И. (Одесса); профессор Козиолова Н.А. (Пермь); к.м.н. Комолятова В.Н. (Москва); к.м.н. Конев А.В. (Москва); к.м.н. Королева О.С. (Москва); к.м.н. Кравчук Б.Б. (Киев); профессор Кузнецов С.И. (Воронеж); д.м.н. Р.М. Линчак (Москва); профессор Макаров Л.М. (Москва); академик РАМН Моисеев В.С. (Москва); профессор Моисеев С.В. (Москва); академик РАН и РАМН Мухин Н.А. (Москва); профессор Ноников В.Е. (Москва); к.м.н. Носкова М.В. (Москва); врач-кардиолог Попова И.В. (Самара); академик РАМН Ревишвили А.Ш. (Москва); к.м.н. Рыбаченко М.С. (Москва); д.м.н. Сайганов С.А. (Санкт-Петербург); к.м.н. Сарычев П.В. (Воронеж); профессор Сидоренко Б.А. (Москва); к.м.н. Смирнов Г.Б. (Санкт-Петербург); к.м.н. Солохин Ю.А. (Москва); к.м.н. Стаферов А.В. (Москва); профессор Тюрина Т.В. (Санкт-Петербург); д.м.н. Фомин В.В. (Москва); д.м.н. Юзвинкевич С.А. (Санкт-Петербург); д.м.н. Явелов И.С. (Москва); профессор Яшин С.М. (Санкт-Петербург).
Общества:
- Всероссийское научное общество терапевтов
- Общество специалистов по сердечной недостаточности
- Всероссийское научное общество специалистов по клинической электро-физиологии, аритмологии и кардиостимуляции
СОДЕРЖАНИЕ
I. ВВЕДЕНИЕ
Смертность от сердечно-сосудистых заболеваний в России является одной из наиболее высоких в мире и составляет 1462 на 100.000 жителей в год [1]. Смертность от сердечно-сосудистых заболеваний в РФ является одной из наиболее высоких в мире и составляет 1462 на 100.000 жителей в год [1]. Основные причины смерти от сердечно-сосудистых заболеваний – прогрессирование хронической сердечной недостаточности (около половины всех летальных исходов) и внезапная сердечная смерть (ВСС) (другая половина). Согласно расчетным данным в РФ внезапно от сердечных причин ежегодно умирает 200.000–250.000 человек[2]. Соответственно, проблема ВСС крайне актуальна для отечественного здравоохранения. Интерес к этой теме обусловлен и тем фактом,
что частота ВСС имеет тенденцию к увеличению. Очевидно так же и то, что существует возможность использования эффективных профилактических мер, направленных на улучшение ситуации.
В представленных Рекомендациях, разработанных на основе современных достижений отечественных и зарубежных специалистов, рассматриваются вопросы прогнозирования и предотвращения ВСС у различных категорий больных и групп населения. Данные Рекомендации позволят широкому кругу врачей (терапевтов, кардиологов, кардиохирургов, рентгенхирургов, реаниматологов) в повседневной клинической
практике выявлять факторы риска ВСС и в каждом конкретном случае разработать оптимальную программу по ее профилактике.
Настоящие Рекомендации являются одним из этапов создания и реализации эффективной программы профилактики ВСС в нашей стране.
В основу настоящих Рекомендаций легло представление об основных и второстепенных факторах риска ВСС.
Выявление основных факторов риска предполагает выбор в пользу более агрессивных методов профилактики ВСС (проведение интервенционного и/или хирургического лечения).
Наличие второстепенных факторов риска ВСС предполагает использование более сдержанной тактики, которая заключается в модификации факторов риска развития основного заболевания у конкретного
больного (например, отказ от курения, снижение массы тела) и оптимизации его медикаментозного лечения.
Читателям, далеким от проблемы ВСС, желающим глубже погрузиться в данную тему, мы рекомендуем:
- Первое, – ознакомиться с I–VI главами;
- Второе, – при работе с пациентом с целью определения риска и осуществления профилактики ВСС следует определиться с основным диагнозом и наличием и/или отсутствием основных факторов риска ВСС. После этого ознакомиться с рубрикой стратификации риска и профилактики ВСС при соответствующем заболевании в главе VII;
- Третье, – рекомендации, представленные в соответствующем разделе главы VII, предлагаем считать руководством к действию.
II. МЕХАНИЗМЫ И ПРИЧИНЫ ВСС. ОПРЕДЕЛЕНИЯ И ТЕРМИНЫ
Определение ВСС. Под внезапной смертью понимают ненасильственную смерть, развившуюся моментально или наступившую в течение часа с момента возникновения острых изменений в клиническом статусе больного [3–5].
Следует различать внезапную сердечную смерть (внезапная смерть от сердечной причины) и внезапную смерть. Критерии диагностики последней сходны с определением ВСС, с тем отличием, что внезапная смерть развивается в результате некардиальных причин, в частности таких как массивная тромбоэмболия легочной артерии, разрыв аневризмы сосудов головного мозга и т.д.
Механизмы ВСС. Согласно данным, полученным при проведении ХМ-ЭКГ у пациентов, умерших внезапно, установлено, что в подавляющем большинстве случаев (85%) механизмами развития ВСС являются желудочковые тахиаритмии – желудочковая тахикардия (ЖТ) и фибрилляция желудочков (ФЖ) с последующим развитием асистолии. Оставшиеся 15% приходятся на долю брадиаритмий и асистолии [6–8] (рис. II.1). Развитие острой левожелудочковой недостаточности на фоне аритмии сопровождается нарушениями, как системной так и регионарной гемодинамики, , прежде всего со стороны ЦНС. В результате могут возникнуть необратимые изменения в жизненно важных органах, приводящие к летальному исходу. Поэтому ключевую роль в клинической интерпретации злокачественного
течения любой аритмии и определения ее жизнеугрожающего характера следует считать: возникновение обморока, предобморока, головокружения, артериальной гипотензии, прогрессирование проявлений сердечной недостаточности, стенокардию. Наличие или отсутствие предсуществующей структурной патологии сердца может иметь определяющее значение для адаптационных изменений параметров сердечного выброса, а значит и для характера клинического течения аритмии.
У пациентов с отсутствием выраженной структурной патологии сердца ВСС, как правило, возникает из-за развития полиморфной ЖТ или ЖТ по типу torsades de pointes [3]. У больных с наличием структурной патологии сердца, в частности с ИБС, желудочковые аритмии возникают либо из-за появления острой ишемии миокарда, либо в результате реализации механизма ре-ентри в области постинфарктного рубца (в этом случае нарушения коронарного кровотока не являются причиной аритмии) [3–5, 9]. Что касается брадисистолических механизмов, то сценарий, связанный с их возникновением, характерен для пациентов с терминальными стадиями структурной патологии сердца и относительно редок (достигает 15%) [3–8].
Пусковыми факторами развития фатальных аритмий могут являться изменения тонуса вегетативной нервной системы (повышение симпатического и/или понижение парасимпатического), физическая нагрузка, прием некоторых лекарственных средств, электролитные нарушения, токсические воздействия, гипоксия.
Вероятность ВСС у лиц с наличием структурной патологии сердца в течение года в 7,5 выше, чем у пациентов без структурной патологии сердца [10, 11]. Среди заболеваний сердца основной причиной ВСС является ИБС, на долю которой приходится до 80% всех случаев [3–8]. Кроме ИБС, ВСС встречается у пациентов с дилатационной ДКМП) [3–8] и гипертрофической кардиомиопатиями (ГКМП) [3–8], аритмогенной дисплазией правого желудочка (АДПЖ) [3–8], при синдромах Бругада и удлиненного интервала QT, аномалиях развития коронарных артерий и других патологических состояниях, перечень которых представлен в таблице II.1.
Таблица II.1
Причины внезапной сердечной смерти
(адаптировано из J. Ruskin, 1998)
| ИБС |
| дилатационная кардиомиопатия |
| гипертрофия левого желудочка |
| гипертрофическая кардиомиопатия |
| приобретенные пороки сердца |
| врожденные пороки сердца |
| острый миокардит |
| аритмогенная дисплазия правого желудочка |
| аномалии развития коронарных артерий |
| саркоидоз |
| амилоидоз |
| опухоли сердца |
| дивертикулы левого желудочка |
| синдром WPW |
| синдром удлиненного интервала QT |
| синдром Бругада |
| катехоламинчувствительная полиморфная |
| желудочковая тахикардия |
| синдром короткого интервала QT |
| лекарственная проаритмия |
| кокаиновая интоксикация |
| выраженный электролитный дисбаланс |
| идиопатическая желудочковая тахикардия |
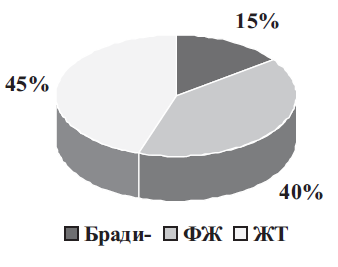
Рис. II.1. Механизмы ВСС. Представлена диаграмма, отображающая роль различных видов нарушения ритма и проводимости сердца в развитии ВСС. Бради – доля радисистолических нарушений приводящих к ВСС; ФЖ – фибрилляция желудочков; ЖТ – желудочковая тахикардия.
Определения и термины. Нам представляется целесообразным в данных Рекомендациях дать определение основным терминам, которые в последующем будут встречаться далее по тексту (таблица II.2).
Словарь терминов (по алфавиту)
Желудочковая тахикардия двунаправленная – ЖТ с альтернацией электрической оси сердца во фронтальной плоскости; ее развитие часто связано с интоксикацией сердечными гликозидами.
Желудочковая тахикардия мономорфная – ЖТ, имеющая неизменную морфологию комплекса QRS в 12 отведениях поверхностной ЭКГ.
Желудочковая тахикардия неустойчивая (НЖТ) – ЖТ, состоящая как минимум из 4-х желудочковых комплексов, максимальной продолжительностью не более 30 с, которая прекращается самостоятельно.
Желудочковая тахикардия по типу torsades de pointes – ЖТ, которая обычно ассоциируется с удлинением интервалов QT или QTc. ЭКГ во время аритмии характеризуется «скручиванием» направленности комплексов QRS относительно изоэлектрической линии.
Желудочковая тахикардия полиморфная – ЖТ, во время которой в 12 отведениях поверхностной ЭКГ изменяется конфигурация комплекса QRS. Частота активации желудочков на фоне ЖТ находится в диапазоне от 100 до 250 в минуту.
Желудочковая тахикардия с циркуляцией импульса по ножкам пучка Гиса по механизму ре-ентри (bundle-branch re-entrant tachycardia) – развивается вследствие реализации механизма ре-ентри в системе Гиса-Пуркинье. Обычно, на поверхностной ЭКГ регистрируется ЖТ с конфигурацией комплекса QRS по типу блокады левой ножки пучка Гиса (БЛНПГ); выскочастотная (около 200 ударов в минуту); часто возникает у пациентов с ДКМП.
Желудочковая тахикардия устойчивая (УЖТ) – это ЖТ продолжительностью более 30 с, зачастую не купирующаяся спонтанно.
Желудочковые нарушения ритма гемодинамически нестабильные – ФЖ, ТЖ, устойчивая/неустойчивая ЖТ и/или желудочковая экстрасистолия, которые сопровождаются выраженными гемодинамически значимыми клиническими проявлениями (головокружение, пресинкопе, синкопе, гипотензия, прогрессирование проявлений сердечной недостаточности, стенокардия).
Желудочковые нарушения ритма гемодинамически стабильные – устойчивая/неустойчивая ЖТ и/или желудочковая экстрасистолия (ЖЭ), которые сопровождаются минимальными клинически проявлениями (например, легкое головокружение, ощущение сердцебиения, тенденция к гипотонии).
Остановка кровообращения (остановка сердца) – прекращение сердечно-сосудистой деятельности
Отношение шансов – мера выраженности связи между состоянием или воздействием и заболеванием или исходом. Шанс возникновения события является отношением между вероятностью его появления и вероятностью его непоявления. Отношение шансов вычисляется в результате деления вероятности появления события в одной группе на вероятность его появления в другой
Пенетрантность – популяционное понятие, означает долю инди
видов, у которых имеются проявления какого-либо признака (заболевания), среди всех лиц, обладающих мутацией в заинтересованном гене;
Пробанд – первый член семьи, который/по поводу которого проводится медико-генетическое консультирование;
Профилактика внезапной сердечной смерти – это комплекс мероприятий, проводимых у лиц, переживших сердечный арест (вторичная профилактика) или у пациентов без эпизодов сердечного ареста в анамнезе, имеющих высокий риск развития ВСС (первичная профилактика).
Распространенность заболевания – доля лиц в популяции, имеющих данное заболевание в данный период времени
Риск относительный – отношение частоты возникновения события в исследуемой группе к частоте возникновения события в контрольной группе
Сердечный арест – это прекращение сердечно-сосудистой деятельности вследствие желудочковой тахикардии и/или фибрилляции желудочков, документированных электрокардиографическим способом (без ЭКГ-верификации не существует дефиниции).
Трепетание желудочков – организованная (колебания длины цикла не превышают 30 мс) желудочковая аритмия с частотой активации желудочков около 300 в минуту (длина цикла – 200
мс), характеризующаяся мономорфной конфигурацией комплексов QRS на поверхностной ЭКГ и отсутствием изоэлектрического интервала между соседними желудочковыми комплексами.
Факторы риска – это клинические признаки, указывающие на вероятность развития ВСС у конкретного пациента в текущем календарном году.
Фибрилляция желудочков – высокочастотный, обычно более 300 ударов в минуту (длина цикла составляет 180 мс и менее) нерегулярный желудочковый ритм с выраженной вариабельностью длины цикла, морфологии и амплитуды комплексов QRS.
Частота встречаемости (инцидентность) заболевания – доля лиц в популяции, у которых заболевание возникает в течение определенного промежутка времени.
Экспрессивность – степень количественной выраженности какого-либо признака (заболевания).
Эффект аритмогенный – прямой результат непредсказуемого электрофизиологического действия антиаритмического препарата на клетки проводящей системы сердца и миокарда, обуславливающий появление новых аритмий
Эффект проаритмический – утяжеление клинического варианта течения и/или ухудшение характеристик предсуществующей аритмии, вследствие назначения антиаритмической терапии
III. Классы рекомендаций и уровни доказательности
Положения настоящих Рекомендаций базируются на современных принципах доказательной медицины и представлены в виде классов показаний с тем или иным уровнем доказательности как для методов диагностики, применяемых при стратификации риска ВСС, так и методов ее профилактики (таблица III.1). Уровень доказательности того или иного положения считается:
- •наивысшим (класс А) – при наличии данных большого количества рандомизированных клинических исследований и/или данных мета-анализа.
- средним (класс В) – при наличии ограниченного количества рандомизированного (одного) и/или нерандомизированных исследований.
- низшим (класс С) – если основанием для его введения послужило описание отдельных клинических случаев и/или мнение экспертов.
Таблица III.1
Классы показаний
Польза и эффективность диагностической процедуры или метода лечения менее обоснованы доказательствами и мнением экспертов
| Класс показаний | Комментарии |
|---|---|
| Класс I | Условия, для которых имеются доказательства и/или единодушие о пользе и эффективности диагностической процедуры или метода лечения |
| Класс II | Условия, для которых имеются противоречивые свидетельства и/или расхождение мнений относительно пользы и эффективности диагностической процедуры или метода лечения |
| Класс IIa | Преобладают доказательства или мнения в пользу диагностической процедуры или метода лечения |
| Класс IIb | |
| Класс III | Условия, для которых имеются доказательства и/или единодушие о том, что данная диагностическая процедура или метод лечения не является полезным и эффективным, а в некоторых случаях может приносить вред |
IV. Эпидемиология ВСС
Данные официальных статистических отчетов в РФ (Центральная база статистических данных Федеральной службы государственной статистики, www.gks.ru/dbscripts/Cbsd) не содержат информации относительно ВСС в структуре смертности населения России. Расчетные данные, составленные с учетом коэффициентов, полученных в ходе эпидемиологических исследований в США и стран Европы, свидетельствуют о широком диапазоне возможной частоты ВСС в России в год – от 141 тысяч человек до 460 тысяч (таблица IV.1). Однако более реальными представляются значения 200–250 тысяч человек в год [12].
Первые эпидемиологические исследования ВСС на территории бывшего СССР были выполнены в 70-х годах прошлого столетия в рамках программы ВОЗ «Регистр острого ИМ» [13]. На 100 000 населения г. Москвы авторами зарегистрировано 78 внезапных смертей у мужчин и 37 – у женщин. Чуть позже сходные данные были получены и в г. Новосибирске [14] и г. Вологде [15]. Эти исследования выявили ряд эпидемиологических особенностей, в частности они установили отчетливую ассоциацию ВСС с распространенностью инфаркта миокарда, а также установили отчетливое преобладание ВСС у мужчин по сравнению с женщинами. Соотношение внезапно умерших мужчин к женщинам составило 2,1–6,6:1.
Таблица IV.1
Численность (2009 г.) и смертность (2010 г.) населения в России
| Показатель | Общее число, n | Доля,% |
|---|---|---|
| Численность постоянного населения | 141 909 244 | |
| Общее число умерших лиц | 2 028516 | 100,0 |
| Число умерших от естественных причин | 1 711 528 | 84,4 |
| Число умерших от болезней системы кровообращения | 1 151 917 | 56,8 |
| Расчетное число умерших лиц по механизму ВСС3 | 141 909 – 460 766 | |
1 – Центральная база статистических данных Федеральной службы государственной статистики, 2009 год (www.gks.ru/dbscripts/Cbsd)
2 – Центральная база статистических данных Федеральной службы государственной статистики, 2010 год (www.gks.ru/dbscripts/Cbsd)
3 – расчетные данные (минимальному числу соответствует 1% от численности населения,
максимальному – 40% от числа умерших от болезней кровообращения).
Недавно закончившееся крупное отечественное исследование РЕЗОНАНС, проведенное в трех российских городах (Рязань, Воронеж, Ханты-Мансийск) и включившее популяцию больных с ИБС численностью 285 736 человек, было спланировано с целью уточнения распространенности ВСС, а также качества диагностики и статистического учета ВСС в медицинских учреждениях [16]. Согласно диагнозам, зарегистрированным в медицинских свидетельствах о смерти, частота ВСС на фоне ИБС составила в мужской популяции – 69 случаев на 100 000 мужского населения в год, в женской – 26 на 100 000 женского населения в год. Однако более детальный дополнительный анализ медицинской документации, опроса родственников, свидетелей смерти, а также лечащих врачей и врачей из бригад скорой медицинской помощи привел к выводу, что уточненная частота ВСС в 2,3 у мужчин и в 2,8 раза у женщин выше зарегистрированного официального уровня и составляет соответственно 156 и 72 случая на 100 000 населения в год. Таким образом в отечественном практическом здравоохранении не выявляется каждый второй случай ВСС у больных ИБС мужского пола, и 2/3 – у больных ИБС женского пола, что приводит к недооценке вероятности развития ВСС в популяции. Основными причинами такого недоучета ВСС у больных ИБС признаны недостаточно активно проведенный диагностический поиск при установлении причины смерти (45,4%) и ошибки оформления медицинской документации (55,6%).
По данным другого российского исследования [17], проведенного в общей популяции г. Москвы, среди всех причин смерти, наступившей вне медицинских учреждений, доля ВСС достигает 39,4% и соответствует 92,5 случаям на 100.000 жителей в год.
В США ежегодный показатель ВСС составляет от 1 до 2 случаев на 1000 населения, что в абсолютных числах соответствует 200 000–450 000 человек [18, 19]. Такие колебания, в основном, обусловлены различиями используемых критериев включения, в первую очередь, связанных с разными временными рамками синдрома ВСС (от 24 часов, применявшихся в 1980–1990 гг., до 1 часа – в современных рекомендациях). Усредненные эпидемиологические показатели в США свидетельствуют о том, что доля ВСС (при условии 1 часового критерия включения) в структуре общей смертности составляет около 13%, а в смертности от болезней системы кровообращения – около 40% [19]. В то же время результаты голландского исследования, в котором использовался 24-часовой критерий диагностики, показали, что частота ВСС составила 18,5% среди всех смертей [20]. В упоминавшемся российском исследовании РЕЗОНАНС [16] в качестве верхнего временного критерия ВСС был признан 12 ч, а расчетная доля ВСС в структуре общей смертности составила 16,3%.
В Европе частота ВСС в целом сопоставима с таковой в США, вместе с тем, она значительно колеблется в различных европейских странах в зависимости от экономического и географического положения [21]. Кроме того, прослеживается отчетливая взаимосвязь междучастотой ВСС и возрастом, полом и распространенностью ИБС [12,22]. Подавляющее большинство случаев (80–85%) ВСС ассоциировано с ИБС, причем более половины из них связано с острым нарушением коронарного кровообращения [23]. Абсолютное количество лучаев ВСС больше у мужчин и увеличивается пропорционально с возрастом в популяции, однако доля ВСС в структуре общей смертностимаксимальна у лиц в возрасте 35–44 лет [23]. В этом же исследовании было показано, что в 80% случаев смерть наступает в домашних условиях, еще в 15% – на улице или в публичном месе. Более чем в третислучаев смерть наступает без свидетелей.
Таким образом, лишь незначительное число пациентов умирают вприсутствии медицинских работников и теоретически имеют большешансов на успешные реанимационные мероприятия и, соответственно,выживание. Эти данные приводят к выводу, что основные мероприятия должны быть сконцентрированы на выявлении групп повышенногориска ВСС и проведении профилактических мероприятий.
Актуальность этого положения наглядно демонстрирует рисунок IV.1.
Частота развития ВСС минимальна в общей популяции , однако, именносреди лиц этой категории регистрируется наибольшее число таких смертей. И, наоборот, в группе наиболее высокого риска ВСС, например, улиц, перенесших остановку сердца, и/или инфаркт миокарда и имеющих желудочковые нарушения ритма, доля ВСС максимальна, но в абсолютных цифрах она значительно меньше таковой в общей опуляции.
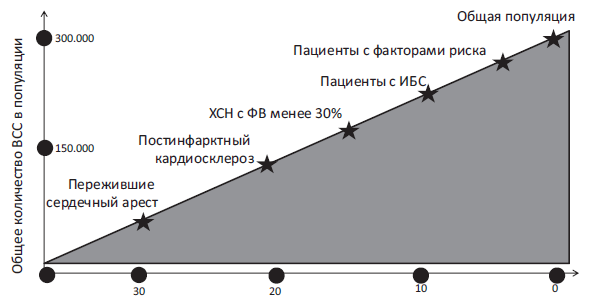
Рис. IV.1. Частота развития и абсолютное число ВСС в общей популяции и специфических группах пациентов (адаптировано из R.J. Myerburg и соавт., 1992). К общей популяции относится неселективная группа пациентов старше 35 лет, подгруппы высокого риска составляют пациенты с множеством факторов риска развития первого коронарного события. Частота развития ВСС минимальна в общей популяции лиц, в которой регистрируется наибольшее число таких смертей. В группах риска доля ВСС наибольшая, но в абсолютных цифрах она значительно меньше таковой в общей популяции.
Эти данные, впервые продемонстрированные почти 20 лет назад, сохраняют актуальность и в настоящее время. Они свидетельствуют, с одной стороны, о том, что эффективность предупреждения ВСС за это время изменилась явно недостаточно, с другой – что крайне важен поиск новых критериев, которые позволили бы идентифицировать группу повышенного риска в общей популяции [12].
V. Факторы риска и стратификация риска ВСС в клинической практике
Частота развития ВСС минимальна в общей популяции, в которой регистрируется наибольшее число таких смертей. При наличии факторов риска ВСС частота ее развития выше, но в абсолютных цифрах она значительно меньше, чем в общей популяции. В этой связи вопрос о прогностической значимости того или иного фактора и их сочетания в отношении риска развития ВСС является чрезвычайно актуальным.
Определение риска развития ВСС складывается из выявления отдельных факторов и определения их значимости у каждого конкретного пациента. Наличие нескольких факторов риска позволяет отнести пациента к определенным клиническим подгруппам, определить риск развития ВСС во времени и, в конечном итоге, определяет оптимальную тактику профилактических мероприятий.
Факторы риска ВСС
На наш взгляд, целесообразно выделять основные и второстепенные факторы риска ВСС. К основным факторам риска относятся эпизод сердечного ареста в анамнезе и/или гемодинамически значимая устойчивая ЖТ, указание в анамнезе на перенесенный инфаркт миокарда (ИМ), эпизоды синкопе, выявленная при инструментальном обследовании систолическая дисфункция, сопровождающаяся снижением фракции выброса левого желудочка (ФВ ЛЖ) менее 40%, ЖЭ и/или эпизоды неустойчивой ЖТ. При наличии у конкретного больного основных факторов риска существует высокая или умеренная вероятность рецидивирования злокачественных ЖНР с развитием острой сердечной недостаточности, и в конечном итоге – ВСС. К второстепенным факторам риска относятся: гипертрофия миокарда левого желудочка (ГЛЖ), артериальная гипертензия (АГ), гиперлипидемия, сахарный диабет (СД), курение, избыточный вес, увеличение частоты сердечных сокращений (ЧСС), гиперсимпатикотония и др. обсуждаемые ниже признаки.
Основные факторы риска
Под основными факторами риска подразумеваются клинические признаки, наличие которых предполагает отнесение больного к категории лиц с высоким или умеренным риском ВСС в течение календарного года (вероятностный риск может достигать 20–50% или 5–15% соответственно).
Эпизод сердечного ареста в анамнезе и/или гемодинамически значимая устойчивая ЖТ. Наиболее серьезным фактором риска развития ВСС является наличие эпизода сердечного ареста в анамнезе. По данным JT Bigger риск ВСС у этой категории пациентов в течение года составляет 30–50% [24]. Эти данные были подтверждены в конце прошлого века в исследованиях, посвященных использованию ИКД в целях вторичной профилактики ВСС (AVID, CASH, CIDS) у данной категории пациентов [25–27].
Указания в анамнезе на перенесенный инфаркт миокарда. Данные, полученные в исследованиях по оценке ААП у пациентов, перенесших ОИМ (EMIAT, CAMIAT и DIAMOND-MI), аритмическая летальность в результате развития ЖТ и ФЖ в течение года составляет 5%, а в течение 2 лет – 9% [28–30].
Систолическая дисфункция левого желудочка. Сниженная ФВ ЛЖ является независимым предиктором общей, сердечно-сосудистой и аритмической смертности. Данное положение было подтверждено как результатами эпидемиологических данных (в т.ч. ЭПОХА), так и результатами исследований, посвященных оценке эффективности ИКД в отношении первичной и вторичной профилактики ВСС, во многих из которых одним из критериев включения являлась систолическая дисфункция [20, 25–27, 31–34].
Синкопальные состояния. Риск ВСС у пациентов с синкопе может быть связан как с наличием структурной патологии сердца, так и с механизмом развития обмороков. Фрамингеймское исследование продемонстрировало, что смертность пациентов с кардиогенными обмороками в течение календарного года значительно выше (до 33%), чем у больных с некардиальными причинами (до 12%) или обмороками неясного генеза (до 6%) [35, 36]. При обмороках рефлекторного происхождения, которые чаще развиваются у молодых людей без структурных заболеваний сердца или электрической нестабильности миокарда, прогноз благоприятный [35]. Тем не менее, имеются наблюдения, свидетельствующие о возможной связи рефлекторных обмороков и ВСС [37]. У молодых спортсменов, склонных к вазовагальным обморокам, не исключается участие рефлекторных механизмов и в обмороках, индуцируемых физической нагрузкой – их результатом иногда являлась смерть в результате асистолии [38]. Исследование EGSYS-2 ставило своей целью определение риска ранней (в течение 1 месяца) и поздней (в течение 2 лет) смертности пациентов с обмороками. Признаками «плохого» краткосрочного прогноза были изменения на ЭКГ, одышка, гематокрит <30%, систолическое АД <90 мм рт. ст., анамнез застойной сердечной недостаточности (The San Francisco Syncope Rule). Риск смерти среди пациентов высокого риска оказался максимальным в течение нескольких дней, следующих за обмороком. Четыре из пяти смертей произошли в течение 48 ч после поступления в отделение неотложной помощи связи с обмороком (STePS study) [39].
Неустойчивая ЖТ и частая ЖЭ. В 70-х годах прошлого века появились работы, в которых было показано, что у пациентов с указаниями в анамнезе на перенесенный ИМ и частую ЖЭ и/или эпизоды неустойчивой ЖТ имеется повышенный риск ВСС. Основываясь на результатах исследований MADIT I и MUSST, посвященных оценке эффективности ИКД у пациентов с ЖЭ и неустойчивой ЖТ, можно утверждать, что устойчивость этих аритмий к ААП IA класса и их трансформация в устойчивую ЖТ в ходе проведения эндоЭФИ является фактором риска ВСС [31].
Второстепенные факторы риска
Под второстепенными факторами риска подразумеваются клинические признаки, наличие которых может определять риск ВСС выше общепопуляционного уровня.
Артериальная гипертензия и гипертрофия левого желудочка. АГ является хорошо известным фактором риска ИБС, хотя данные о том, что наличие АГ является фактором риска развития ВСС остаются противоречивыми [40, 41]. ГЛЖ является морфологическим субстратом, благодаря которому АГ предрасполагает к высокому риску развития ВСС вследствие ЖА. К факторам, способствующим развитию ГЛЖ относят возраст, избыточный вес, нарушения толерантности к глюкозе, генетические изменения [42]. Известно, что наличие ЭКГ-признаков ГЛЖ (увеличение вольтажа зубцов R и нарушений реполяризации) ассоциируется с 33%-ой и 21%-ой летальностью в течение 5 лет у мужчин и женщин соответственно [42].
Риск развития ВСС при условии наличия ЭКГ-признаков ГЛЖ сопоставим с таковым у пациентов с ИБС и ХСН. В ряде исследований было установлено, что увеличение массы миокарда ЛЖ, выявляемое при проведении ЭХО-КГ, характеризуется риском ВСС. По данным Фрамингеймского исследования отношение рисков (ОР) развития ВСС было 1,45 (95%-ДИ 1,10–1.92, P=0,008) для каждых 50 г/м2 увеличения массы ЛЖ при условии наличия других факторов риска [43]. Верифицированная на ЭКГ или ЭХО-КГ ГЛЖ, является независимым фактором риска развития сердечно-сосудистых событий. А наличие как ЭКГ, так и ЭХО-КГ-признаков ГЛЖ еще в большей степени увеличивает этот риск. Результаты, полученные в рандомизированных контро20 V. Факторы риска и стратификация риска ВСС в клинической практике V. Факторы риска и стратификация риска ВСС в клинической практике 21 лируемых исследованиях, не дают исчерпывающего ответа на вопрос, как влияет снижение АД на риск развития ВСС. Известно, что у пожилых мужчин с изолированной систолической гипертензией риск развития ВСС выше, чем у женщин [41]. Данный факт косвенным образом согласуется с данными результатов исследований по лечению изолированной систолической гипертензией у пожилых лиц, в которых отмечается уменьшение общей смертности на 17% и смертности от ОИМ, включая ВСС на 25% на фоне коррекции АГ [44]. Данные мета-анализа результатов рандомизированных исследований по снижению АД у пациентов среднего возраста с преимущественно диастолической АГ [45] свидетельствуют о 14% (95 ДИ 4–22%, P<0,01) снижении смертности от ИБС или нефатального ОИМ.
Липиды. Хорошо известна зависимость между высоким уровнем холестерина и риском развития ИБС, включая ВСС [46–48]. В клинических исследованиях, посвященных оценке влияния снижения уровня липидов в целях первичной профилактики ИБС, риск развития ВСС специально не определялся и статистически достоверные данные на этот счет отсутствуют. Если предположить, что снижение риска ВСС будет происходить параллельно со снижением смертности от ИБС и ОИМ, то назначение статинов может иметь значение для уменьшения относительного риска ВСС на 30–40% [49, 50]. Многие эпидемиологические исследования свидетельствуют о том, что высокий риск развития ИБС (вероятно и ВСС), ассоциируется с диетой, включающей повышенное содержание насыщенных жирных кислот, и низкой представленностью полиненасыщенных [51]. На сегодняшний день отсутствуют данные о том, что диета с высоким содержанием насыщенных жирных кислот увеличивает риск развития ВСС. Тем не менее, в исследовании US Physicians Study, в котором принимало участие 20551 мужчин в возрасте от 40 до 84 лет ранее не переносивших ОИМ, было установлено, что еженедельное употреблении рыбы снижает относительный риск развития ВСС в 2 раза (95% ДИ 0,24–0,96; P=0,04). Этот эффект не зависел от наличия других факторов риска [52]. Использование в рационе морепродуктов с высоким содержанием ПНЖК также ассоциировалось с уменьшением риска ВСС.
Физическая активность. Существует взаимосвязь между интенсивной физической нагрузкой и развитием ВСС. Тем не менее, механизм ее развития остается неясным. В большинстве случаев лица, умершие внезапно во время физической нагрузки, ранее регулярно не тренировались [53]. Таким образом, риск развития ВСС или ОИМ повышается у нетренированных лиц, во время интенсивной физической нагрузки. В популяционном исследовании было установлено, что после модификации факторов риска ИБС относительный риск развития ВСС при умеренной физической активности (работа в саду, пешие прогулки) или интенсивных регулярных тренировках (более 60 минут/неделю) находится в диапазоне в 3–4 раза ниже, чем у лиц, у которых отсутствует подобная физическая активность [54]. Результаты этого исследования показали, что отсутствие физической активности является причиной развития коронарных событий (стенокардия, ОКС, ОИМ) в 43% (95% ДИ 26–60), даже при условии эффективной модификации таких факторов риска как курение, эффективный контроль АД и употребление алкоголя.
Употребление алкоголя. Неоднозначны данные о взаимосвязи употребления алкоголя и ВСС. Избыточное употребление крепких алкогольных напитков увеличивает риск развития ВСС [47, 55]. Этот факт может объясняться увеличением интервала QT, которое нередко встречается у алкоголиков [56]. С другой стороны, имеются данные исследований о протективном действии небольших доз алкоголя в отношении развития жизнеугрожающих желудочковых аритмий [57]. В проспективном исследовании British Regional Heart Survey было показано, что употребление алкогольных напитков в небольшом количестве ассоциируется со снижением риска фатального исхода при развитии первого большого коронарного события (ОР 0,61, P<0,05)[47].
ЧСС и вариабельность ритма сердца. Увеличение ЧСС является независимым фактором риска ВСС [46, 47]. Взаимосвязь высокой ЧСС и риска развития ВСС отмечается как у лиц с диагностированным ранее заболеванием сердца, так и без него, вне зависимости от индекса массы тела и уровня физической активности [46]. Причина этой взаимосвязи до конца неизвестна. Одним из объяснений является уменьшение активности парасимпатической нервной системы. Исследования вариабельности ритма сердца свидетельствуют о том, что в мужской популяции относительный риск общей смертности у пациентов среднего возраста в течение 5 лет наблюдения был выше в 2,1 раза (95% ДИ 1,4–3,0) в случаях, когда показатель SDNN был менее 20 мс, в сравнении с лицами сопоставимыми по возрасту, у которых величина SDNN составляла 20–39 мс [58].
Курение. В популяционных исследованиях было установлено, что курение является независимым фактором риска как ВСС, так и ОИМ [47, 48]. Это положение относится в т.ч. и к лицам, у которых нет признаков ИБС [59, 60]. Курение является важным долгосрочным фактором риска развития ВСС [46]. Также известно, что курение является мощным предиктором развития именно ВСС, а не ВСС от ИБС [47].
Однако в ряде исследований данные о непропорциональном влиянии курения на ВСС не были подтверждены [47]. Продолжение курения после пережитого вне лечебного учреждения сердечного ареста является независимым предиктором развития повторного эпизода ВСС [60].
Сахарный диабет. Является ли нарушение толерантности к глюкозе независимым предиктором ВСС неизвестно. Так в исследовании Honolulu Heart Program в течение 23 лет наблюдались 8006 пациентов. Было установлено, что у лиц с нарушением толерантности к глюкозе и сахарным диабетом величина относительного риска развития ВСС составила 2,22 и 2,76 (P=0,05) соответственно [61]. Схожие данные были получены в Австрии (ОШ=4,2, 95% ДИ 1,39–12,81) [47]. Во Франции ретроспективный анализ более 18000 ВСС показал, что СД является фактором риска ВСС только у лиц с ИБС [62]. Проспективные исследования, проведенные в Финляндии и Великобритании, подтвердили положение о том, что СД не является независимым предиктором ВСС [47, 62].
Изменения на ЭКГ. Депрессия сегмента ST и изменения T-волны являются информативными в диагностике ИБС и ГЛЖ. Существует взаимосвязь между депрессией сегмента ST и изменениями волны T и высоким риском развития сердечно-сосудистой смерти. В частности, в Бельгии анализ ЭКГ 9117 мужчин и женщин у которых в анамнезе не было указаний на эпизоды стенокардии или перенесенный ОИМ, показал, что ишемические изменения на ЭКГ были выявлены у 8,4% мужчин и 10,6% женщин. После проведения мероприятий в отношении коррекции других факторов риска сердечно-сосудистых заболеваний относительный риск развития сердечно-сосудистой смертности у мужчин составил 2,45 (95% ДИ 1,70–3,53) и 2,16 (95% ДИ 1,30–3,58) у женщин [63]. Эти данные также были подтверждены рядом других исследований [64]. Для прогнозирования развития ВСС имеет значение увеличение величины интервала QT или его дисперсия. Анализ данных популяционных исследований показал, что увеличение интервала QT может быть также связано со структурной патологией сердца (ГЛЖ). Величина интервала QT> 420 ms является предиктором ВСС [65, 66]. Убедительных данных о том, что дисперсия интервала QT является предиктором ВСС получено не было [66–68].
Стратификация риска развития ВСС
В 1984 г. J.T. Bigger выделил факторы, определяющие вероятностный риск развития ВСС в течение календарного года (таблица. V.1). В наших рекомендациях эти факторы рассматриваются как основные. Они использовались как критерии включения в исследования по оценке эффективности имплантируемых кардиовертеров-дефибрилляторов (ИКД) для профилактики ВСС [24–26, 30–34].
Реализация ВСС происходит по аритмическому механизму, и следовательно, выявление того или иного вида нарушений ритма и проводимости сердца у каждого конкретного пациента будет требовать их прогностической оценки в отношении риска ВСС. В этой связи заслуживает внимание стратификация риска развития ВСС у пациентов с нарушениями ритма и проводимости сердца вне зависимости от наличия или отсутствия структурной патологии сердца, предложенная R. Fogoros [69] (таблица V.2). Эта классификация, на наш взгляд, вносит определенность в представление о жизнеугрожающих нарушениях ритма сердца.
Таким образом, представляется возможным определиться со злокачественным течением аритмии не только на основании ее выраженной гемодинамической значимости, но и базируясь на ее электрокардиографическом портрете.
Таблица V.1
Риск развития ВСС (по Bigger JT, 1984)
| Группа риска | Риск развития ВСС в текущем году |
|---|---|
| Группа умеренного риска | |
| ОИМ в анамнезе или ФВ ниже 40% | 5% |
| ОИМ+ФВ ниже 40% или ОИМ + частая ЖЭ или ФВ ниже 40% + ЖЭ | 10% |
| ОИМ + ФВ ниже 40% + ЖЭ | 15% |
| Группа высокого риска | |
| пациенты, пережившие ВСС | 30–50% |
| ЖТ + синкопе | 30–50% |
| ЖТ + минимальные клинические проявления | 20–30% |
Примечание: ОИМ – острый инфаркт миокарда; ФВ – фракция выброса левого желудочка; ЖЭ – желудочковая экстрасистолия; ВСС – внезапная сердечная смерть; ЖТ – желудочковая тахикардия
Таблица V.2
Риск внезапной сердечной смерти у пациентов с нарушениями ритма и проводимости сердца (по R.Fogoros, 2006)
| Высокий | Средний | Низкий |
| Фибрилляция желудочков. Желудочковая тахикардия АВ-блокада III ст. с низкой частотой замещающего ритма Синдром WPW с антероградным проведением по ДАВС на фоне фибрилляции предсердий |
Желудочковая эктопия на фоне структурной патологии сердца АВ-блокада II ст. АВ-блокада III ст. с адекватной частотой замещающего ритма Фибрилляция предсердий |
Предсердная эктопия
Желудочковая эктопия без структурной патологии сердца Суправентрикулярные тахикардии АВ-блокада I ст. |
Примечание: ДАВС – добавочное атриовентрикулярное соединение; WPW – ВольфПарокинсон-Уайт, АВ – атриовентрикулярная
Методы исследования, необходимые для стратификации риска ВСС
Определение риска развития ВСС основано на клинической оценке
пациента, включающей в себя данные анамнеза, физикального осмотра и результаты, проведенных инструментальных исследований. В таблице V.3 представлен перечень основных инструментальных и лабораторных исследований, выполнение которых необходимо для определения риска ВСС, а также классы показаний к их проведению и уровни доказательности.
Таблица V.3
Инструментальные исследования, проведение которых может быть необходимо для стратификации риска ВСС
| Исследование | Комментарии | Класс показаний | Уровень доказательности |
|---|---|---|---|
| Электрокардиография: | |||
| 12 отведений поверхностной ЭКГ | Позволяет выявить врожденные аномалии, связанные с высоким риском развития ВСС (например, синдром удлиненного интервала QT, синдром укороченного интервала QT, синдром Бругада, АДПЖ), а также определить иные ЭКГкритерии (например, признаки лектролитных расстройств, нарушения проводимости в системе Гиса–Пуркинье, признаки ГЛЖ). | I | C |
| Холтеровское мониторирование ЭКГ | Показано пациентам с аритмической симптоматикой, чтобы определить, вызвана ли она аритмиями потенциально угрожающими жизни пациента (см. табл. V.2) | I | В |
| Показано пациентам с наличием ЖЭ на ЭКГ в отсутствии каких-либо иных симптомов | I | В | |
| Нагрузочные пробы | Рекомендованы взрослым пациентам, имеющим факторы риска развития ИБС и симптоматику, которая, возможно, связана с аритмиями | I | В |
| Показаны пациентам с верифицированными ранее или предполагаемыми ЖА, возникающими на фоне физической нагрузки, включая катехоламинзависимую ЖТ, для учреждения диагноза и определения клинической значимости тахикардии для пациента | I | B | |
| Показаны пациентам среднего и старшего возраста с наличием ЖЭ на ЭКГ в отсутствие каких-либо иных симптомов. | IIb | С | |
| Имплантируемые записывающие устройства | Имплантация показана пациентам со слабо выраженной симптоматикой, которая, возможно, связана с аритмиями, например, в случае обморочных состояний (ОС), если при помощи обычного диагностического ЭКГ-исследования невозможно установить причинно-следственную взаимосвязь между нарушением ритма сердца и развитием симптоматики | I | B |
| Эхокардиография | Показана пациентам с подозрением на структурную патологию сердца | I | В |
| I В Показана пациентам с высоким риском развития ВСС и кардиомиопатиями (ДКМП, ГКМП, АДПЖ), постинфарктным кардиосклерозом и родственникам пациентов с наследственными заболеваниями, ассоциированными с риском развития ВСС. | I | В | |
| Нагрузочное тестирование с возможностью Эхо-КГ-визуализации для выявления безболевой формы ишемии миокарда рекомендованы пациентам с ЖА, с умеренным риском развития ИБС, получающим сердечные гликозиды; пациентам с ГЛЖ; пациентам с депрессией сегмента ST в покое более 1 мм, пациентам с синдромом WPW или при наличии признаков БЛНПГ. | I | В | |
| Эхо-КГ с фармакологической нагрузкой рекомендуется для выявления безболевой формы ишемии миокарда у пациентов с умеренным риском развития ИБС, которые физически не способны выполнить нагрузочную пробу. | I | В | |
| Медикогенетическое консультирование и генетическое тестирование (ДНК-диагностика). | Направлено на выявление и/или уточнение диагноза наследственного заболевания. Включает обсуждение с пациентом и/или членами его семьи информации о наследственной природе заболевания, типе наследования, оценке риска повторного рождения ребенка с заболеванием или риска передачи заболевания потомкам. Предоставление информации о естественном течении заболевания, специфических факторах риска, возможных мерах профилактики, лечения и/или поддерживающей терапии, а также о выборе возможных репродуктивных стратегий. Рекомендуется всем больным и их родственникам с семейными заболеваниями, и должно включать обсуждение возможностей проведения клинического обследования, преимуществ и. рисков генетического тестирования | ||
| Магнитнорезонансная томография (МРТ), компьютерной томографии (КТ) сердца | Показана пациентам с ЖА в тех случаях, когда ЭхоКГ не позволяет точно оценить функцию ЛЖ и ПЖ и/или выявить их структурные изменения. | IIa | В |
| Коронарография | Показана пациентам с ИБС и угрожающими жизни ЖА (высокий и средний риск ВСС, см. табл. V.2), а также лицам пережившим сердечный арест | I | C |
| Эндокардиальное электрофизиологическое исследование (ЭндоЭФИ) | ЭндоЭФИ с использованием фармакологических средств может быть использовано для оценки клинической значимости аритмии и стратификации риска ВСС. ЭндоЭФИ также используется для индукции и верификации ЖТ, контроля эффективности назначенной ААТ, проведенной катетерной абляции, определения риска развития ЖТ или ВСС, в диагностике обмороков, для определения показаний к имплантации ИКД. | Классы показаний и уровни доказательности определяются в каждом конкретном клиническом случае и регламентируются Национальными Рекомендациями ВНОА 2011 г. [70]. | |
Примечание: АДПЖ – аритмогенная дисплазия правого желудочка; ГЛЖ – гипертрофия левого желудочка; ЖЭ – желудочковая экстрасистолия; ЖА – желудочковая аритмия; ДКМП – дилатационная кардиомиопатия; ГКМП – гипертрофическая кардиомиопатия; БЛНПГ – блокада левой ножки пучка Гиса; ИКД – имплантируемый кардиовертер-дефибриллятор; ЭхоКГ – эхокардиография; ВНОА – Всероссийское научное общество аритмологов.
VI. ПРОФИЛАКТИКА ВСС
Профилактика ВСС – это комплекс мероприятий, проводимых с целью предупреждения или уменьшения вероятности развития ВСС, который осуществляется у лиц переживших сердечный арест (вторичная профилактика) или у пациентов без эпизодов сердечного ареста в анамнезе, но имеющих факторы риска развития ВСС (первичная профилактика). Профилактика риска ВСС должна включать в себя модификацию факторов риска развития заболеваний, а также проведение адекватного медикаментозного лечения основной и сопутствующей патологии. Современная эффективная профилактика ВСС основана на комплексном подходе, включающем в себя применение медикаментозных, интервенционных и хирургических методов профилактики ВСС. Объем проводимых профилактических мероприятий будет определяться в зависимости от того к какой категории будет отнесен каждый конкретный пациент.
Медикаментозные методы
Использование различных групп медикаментозных средств с целью первичной или вторичной профилактики ВСС имеет различный класс показаний и уровень доказательности и определяется нозологической формой основного заболевания, ФК ХСН, состоянием систолической функции миокарда ЛЖ, клинической симптоматикой, характером нарушений ритма. С этой целью могут использоваться как препараты, относящиеся к средствам лечения основного заболевания, так, собственно, антиаритмические препараты (ААП).
Бета-адреноблокаторы. Положительное влияние бета-блокаторов и их разнообразные эффекты хорошо изучены в экспериментах и в клинике. Антиаритмический эффект бета-блокаторов связывают как
с их антиишемическим действием, так и со снижением симпатической активности. Мета-анализ 25 исследований, касающихся оценки влияния данных препаратов на выживаемость у постинфарктных больных, включавший почти 25000 больных, выявил, что назначение бета-блокаторов сопровождается увеличением выживаемости, снижением общей и сердечно-сосудистой летальности, а также уменьшением частоты развития ВСС [71]. Положительные эффекты бета-блокаторов в отношении ЖА и ВСС также доказаны и для больных с ХСН ишемической и неишемической природы (ДКМП, ГКМП, синдромом удлиненного QT, катехоламинергической полиморфной ЖТ, АДПЖ, аортальным стенозом) [72–75]. Преимущество ББ заключается также в том, что их можно сочетать с другими ААП, в частности, – с амиодароном. [76]. Выбор бета-блокатора и подходы к титрованию доз определяются основным заболеванием, которое имеется у больного (перенесенный ОИМ, ХСН, АГ и другие). Таким образом, бета-блокаторы являются эффективным и, при надлежащем отборе больных и подходах к подбору доз, безопасными средствами, имеют самую большую доказательную базу и в настоящее время должны рассматриваться в качестве препаратов первой линии для проведения первичной и вторичной профилактики ВСС (I, A) [4, 12].
Ингибиторы АПФ и блокаторы ангиотензиновых рецепторов. Положительные эффекты ингибиторов АПФ на течение ИБС хорошо известно. Эта группа препаратов влияет на электрофизиологические процессы в миокарде, воздействуя на функцию К- и Са-каналов, а также увеличивают рефрактерность и реполяризацию миокарда желудочков, предупреждая развитие аритмий по механизму ре-ентри, у больных с ХСН и ФЖ ишемического генеза. Антиаритмическое действие иАПФ также объясняется их угнетающим действием на симпатическую нервную систему. Они ингибируют циркулирующие катехоламины и ангиотензин-2, повышают уровень калия в крови. В нескольких работах было показано, что иАПФ повышают чувствительность барорефлекса и улучшают показатели ВСР. Наконец, антиаритмический эффект иАПФ может объясняться противовоспалительными свойствами и уменьшением выраженности процессов постинфарктного ремоделирования миокарда на фоне их применения.
Доказательства положительного влияния иАПФ на выживаемость больных, перенесших ОИМ, а также на больных с сердечной недостаточностью как ишемической, так и неишемической природы получены в большом количестве клинических исследований, показавших, что иАПФ достоверно снижают общую и сердечно-сосудистую летальность у данной категории пациентов [77–82]. Однако, в отличие от бета-блокаторов в большинстве этих клинических испытаний, ВCС в качестве конечной точки не рассматривалась. Исключением является рандомизированное исследование TRACE, в котором изучалось влияние трандолаприла на ВCС, где был доказан положительный результат [82]. Следует заметить, что верификация механизма смерти, особенно при ВСС, представляет известные трудности, особенно – в клинических исследованиях, когда случаи смерти, как правило, оцениваются ретроспективно. Вместе с тем, не вызывает сомнений тот факт, что почти половина больных ИБС, в особенности лица перенесшие ОИМ, погибают внезапно. Очевидно, мы имеем право экстраполировать полученные убедительные результаты о снижении с помощью иАПФ сердечно-сосудистой летальности и на ВСС. Подтверждением вышесказанному является крупный мета-анализ [80], целью которого была оценка влияния иАПФ на риск развития ВСС. Результаты этого анализа, включавшего данные 15104 пациентов, принимавших участие в 30 исследованиях (из них 15 были слепые, рандомизированные плацебо-контролируемые), показали, что назначение иАПФ пациентам, перенесшим ИМ, сопровождается уменьшением общей и сердечно-сосудистой смертности, при этом частота развития ВСС снижается на 20% (2356 случаев смерти, из них внезапной – 900). В связи с этим положение об эффективности иАПФ для профилактики ВСС у больных, перенесших ИМ и пациентов с ХСН (систолической дисфункцией) присутствует во всех современных отечественных и зарубежных рекомендациях по профилактике ВСС и имеет самый высокий уровень доказательности (I, A).
Что касается данных об эффективности иАПФ для предупреждения ВСС у больных с сохранной функцией левого желудочка, то информации на эту тему существенно меньше. Имеются результаты нескольких исследований (HOPE, EUROPA), показавших преимущества таких препаратов, как рамиприл и периндоприл в отношении предотвращения ВСС у больных с высоким риском развития сердечно-сосудистых осложнений [78, 79]. Следует отметить, что в этих исследованиях ВСС не рассматривалась в качестве самостоятельной конечной точки. Тем не менее, назначение иАПФ рекомендуются больным ХСН с сохранной функцией левого желудочка, так как предупреждает развитие и прогрессирование ХСН (IIа, B).
Таким образом, иАПФ также входят в группу препаратов необходимых для профилактики ВСС, прежде всего, у постинфарктных больных и пациентов с сердечной недостаточностью.
Что касается блокаторов ангиотензиновых рецепторов, то в плане снижения смертности при ХСН их доказательная база меньше чем у иАПФ. Известны положительные результаты о снижении риска сердечно-сосудистой смертности у больных с ХСН, получавших валсартан и лозартан. В исследовании CHARM [83] представитель этой группы препаратов – кандесартан у пациентов с ХСН и сниженной систолической функцией миокарда ЛЖ доказал выраженную эффективность в снижении показателей смертности от сердечно-сосудистых причин и характеристик внезапной смертности (15% – снижение риска, р=0,036). Поэтому, по-видимому, в настоящее время кандесартан может использоваться для профилактики ВСС у больных ХСН и сниженной ФВ ЛЖ, наравне с иАПФ. В отношении предупреждения ВСС с помощью блокаторов ангиотензиновых рецепторов у больных с сохранной функцией ЛЖ в настоящее время отсутствуют убедительные данные.
Антагонисты альдостерона. Ретроспективный анализ исследования SOLVD (6797 больных, 424 случая смерти) продемонстрировал взаимосвязь между применением диуретиков при ХСН и риском ВСС. Причем, при использовании калийсберегающих диуретиков, как отдельно, так и в комбинации с другими мочегонными, такая взаимосвязь не прослеживалась. Исследование RALES (1663 больных) было прекращено досрочно, так как у больных с выраженной ХСН, принимавших спиронолактон, по сравнению с больными, использовавшими петлевые диуретики, через 2 года наблюдения были достоверно ниже показатели общей летальности (35% против 46%) и ВСС (10% против 13%). При этом существенного уменьшения частоты выявления желудочковых аритмий не было отмечено [84]. Показано, что электролитные нарушения, возникающие при назначении некалийсберегающих диуретиков, могут способствовать развитию фатальных аритмий, тогда как антагонисты альдостерона, вероятно, играют протективную роль. В дальнейшем было оказано, что антиаритмический эффект данных препаратов более сложен. Блокада альдостероновых рецепторов помимо сохранения калия и магния приводит к устранению системной вазоконстрикции, предупреждает стимуляцию образования коллагена и развитие фиброза в миокарде, а также оказывает влияние на автономную нервную систему, являющуюся активным участником аритмогенеза, улучшая показатели ВСР и повышая чувствительность барорефлекса [85, 86]. В последние годы стали доступны результаты применения нового антагониста альдостерона – эплеренона, которые подтверждают эффективность этой группы препаратов в снижении риска ВСС. Следовательно, для предупреждения ВСС у больных с ХСН в схему терапии рекомендуется включать антагонисты альдостерона (I, A), причем не только при застойной сердечной недостаточности, но и при ХСН II ФК [87] .
Ацетилсалициловая кислота. Убедительно доказано, что назначение ацетилсалициловой кислоты имеет позитивное значение как для первичной, так и вторичной профилактики коронарных событий. Помимо дезаггрегантных свойств имеет значение противовоспалительное действие препарата, что уменьшает процессы ремоделирования в здоровых тканях. Ретроспективный анализ результатов исследования SOLVD показал, что у больных с ХСН назначение ацетилсалициловой кислоты на 24% снижало частоту развития ВСС [88]. Согласно существующим рекомендациям данный препарат входит в стандарты профилактического лечения как у больных перенесших ОИМ, так и у пациентов со стабильной стенокардией и острым коронарным синдромом (I, A).
Статины. Обзор данных литературы свидетельствует о существенном снижении сердечно-сосудистой смертности при использования статинов у больных ИБС. В большинстве из проведенных клинических испытаний ВСС, как отдельная конечная точка, не оценивалась. Тем не менее, в исследовании 4S при применении симвастатина наряду с существенным снижением общей смертности и смертности от коронарной болезни сердца отмечалась тенденция к уменьшению частоты ВСС. Аналогичные результаты были получены в отношении правастатина (LIPID). Крупный мета-анализ, включавший 90 000 пациентов, принимавших участие в 14 рандомизированных исследованиях, проведенный до 2005 года, доказал ффективность статинов для профилактики ВСС у больных ИБС [89]. Поэтому в существующих рекомендациях по профилактике ВСС использование статинов у больных ИБС признается необходимым (I, A) [4, 12, 90]. Для профилактики развития сердечно-сосудистых осложнений назначение статинов рекомендуется всем больным, относящимся к группе высокого сердечно-сосудистого риска. Что касается применения статинов для профилактики ВСС у пациентов с ХСН неишемической этиологии, то доказательной базы для этой категории ольных в настоящее время не существует.
ω3-полиненасыщенные жирные кислоты (ПНЖК). Первые сообщения об эффективности ПНЖК для профилактики ВСС были получены в исследовании DART, которое продемонстрировало, что у лиц, употреблявших два раза в неделю и более жирную рыбу, наблюдалось 30%-е снижение частоты сердечно-сосудистой летальности, преимущественно за счет уменьшения случаев ФЖ.
В дальнейшем гипотеза была проверена в экспериментах на животных, и в частности, было показано, что ω3-ПНЖК, основные жирные кислоты, присутствующие в жирной рыбе, оказывают протективное действие в отношении ФЖ. Были изучены механизмы антиаритмического действия ω3-ПНЖК, которые заключаются в том, что последние в условиях ишемии или адренергической стимуляции стабилизируют мембрану кардиомиоцитов, влияя на работу натриевых, калиевых и кальциевых ионных каналов, действуя подобно ААП Ib класса (мексилетин-подобное действие), но не обладая при этом проаритмическим и аритмогенным эффектами. С электрофизиологической точки зрения защитное действие от назанчения ω3-ПНЖК заключается в том, что на фоне их применения необходима большая амплитуда электрического экстрастимула для индукции «аритмического» потенциала действия, а также отмечается увеличение длительности эффективного рефрактерного периода кардиомиоцитов, что предупреждает запуск фатальных аритмий, в том числе и ФЖ [91].
Помимо суррогатного слабовыраженного антиаритмического действия эти препараты обладают противовоспалительным действием, снижают образование кислородных радикалов и уменьшают реперфузионные осложнения, повышают синтез энергии в митохондриях, улучшают эндотелиальную функцию, снижают уровень тромбоксана и агрегацию тромбоцитов. В ряде работ показано, что ω3-ПНЖК увеличивают параметры ФВ ЛЖ и улучшают показатели ВСР, оказывая, таким образом, модифицирующее влияния на основные и второстепенные факторы риска ВСС [92].
Убедительная доказательная база в отношении ω3-ПНЖК была получена в двух крупных исследованиях. В исследовании GISSI-prevenzione у больных с ОИМ применение омакора в дозе 1 г/сут сопровождалось достоверным снижением риска ВСС на 45%, сердечно- сосудистой смертности на 30% и уменьшением риска общей смерти на 20% [93]. Результаты многоцентрового двойного слепого плацебо-контролируемого исследования GISSI-HF, опубликованные в 2008 году показали, что назначение омакора в дозе 1 г/сут у больных с ХСН на фоне оптимальной медикаментозной терапии сопровождается снижением риска общей смерти на 9% и уменьшение количества госпитализаций по причине желудочковых нарушений ритма. При этом количество побочных эффектов в группе лечения ω3-ПНЖК не отличалось от группы контроля [94].
Существуют ряд публикаций, в которых показано влияние омакора на выраженность желудочковых нарушений ритма. В одной из них, уже через месяц от начала терапии, добавление ω3-ПНЖК пациентам со стабильной ИБС привело к статистически достоверному уменьшению числа эпизодов неустойчивой ЖТ и числа парных желудочковых экстрасистол [95].
Таким образом, к настоящему времени убедительно продемонстрирован профилактический эффект ω3-ПНЖК у больных, перенесших ОИМ в отношении риска развития ВСС. Согласно существующим рекомендациям, больным, перенесшим ИМ, следует употреблять в день 1 грамм ω3-ПНЖК, а именно – омакор, а также устраивать «рыбные дни» (около 200 г жирной рыбы), по меньшей мере, дважды в неделю [96, 97]. Данных о возможности использования омега-3 ПНЖК для вторичной профилактики ВСС у больных, переживших остановку кровообращения, в настоящее время недостаточно, но исследования на эту тему, в частности у больных с ИКД, – продолжаются.
Нитраты. Поскольку одним из механизмов ВСС могут быть ишемические события, вероятно, одним из путей профилактики ВСС у этих больных могут быть нитраты. Долгосрочных рандомизированных исследований, оценивавших эффект антиангинальной терапии на ЖНР, не проводилось и они не включены в международные и отечественные рекомендации по их лечению. Тем не менее, имеются данные, свидетельствующие о положительном влиянии терапии нитратами на желудочковую эктопическую активность, и их назначение может обсуждаться при лечении ишемических ЖНР [98].
ААП IC класса. Применение ААП для профилактики ВСС имеет значительные ограничения, а в ряде случаев, согласно данным многоцентровых рандомизированных исследований, может привести к увеличению риска серьезных нежелательных последствий. В частности, согласно данным исследований CAST и CAST-II назначение препаратов IC класса пациентам с ЖНР и указаниями в анамнезе на перенесенный ранее ОИМ сопровождается достоверным увеличением характеристик ВСС [99, 100]. Тем не менее, существует ряд ситуаций, при которых назначение ААТ может быть оправдано.
Прежде всего, это пациенты с имплантированными кардиовертерамидефебрилляторами (ИКД) и частыми обоснованными срабатываниями по поводу рецидивирующей ЖТ/ФЖ. Такая ситуация в своих крайних проявлениях называется аритмическим штормом и обусловливает необходимость дополнительного назначения ААТ для терапии ЖТ и уменьшения количества эпизодов терапии ИКД.
Амиодарон и соталол. Антиаритмический эффект препаратов III класса, таких, как амиодарон и соталол связан с удлинением потенциала действия и увеличением длительности рефрактерного периода, что способствует прерыванию циркуляции электрического импульса в петле ре-ентри, а также подавляет аритмии, возникающие по триггерному механизму. Положительное влияние амиодарона и соталола при аритмиях связано, в том числе с их антиишемическим действием, уменьшением ЧСС, нейромодулирующими воздействиями и влиянием на сократительную функцию левого желудочка [101]. Вопрос о влиянии данных препаратов на выживаемость при их долгосрочном назначении остается открытым. Ряд клинических испытаний и один мета-анализ, включавший ескольких крупных исследований, продемонстрировали снижение частоты ВСС при назначении амиодарона у пациентов с дисфункцией ЛЖ после перенесенного ОИМ и неишемической ДКМП [102]. Однако большинство больных в этих клинических исследований наряду с амиодароном принимали и бетаблокаторы. Крупное, хорошо спланированное исследование SCD-HeFT, в котором оценивалась профилактическая эффективность амиодарона в отношении предотвращения ВСС при ХСН, не выявило его преимуществ по сравнению с плацебо у больных с IV ФК ХСН [103].
Вместе с тем, следует отметить, что соталол, как и амиодарон, являются наиболее эффективными средствами при лечении ЖА. Их назначение приводит к удлинению интервала QT и может оказывать, таким образом, проаритмическое действие.
В настоящее время нет убедительных данных об улучшении выживаемости при использовании ААП III класса у больных с кардиальной патологией и ЖНР. Их назначение может быть оправдано у пациентов с ЖА в сочетании с бета-адреноблокаторами (для амиодарона – IIa, B; для соталола – IIa, С) при тщательном контроле за возможными побочными эффектами от их назначения, а также аритмогенными и проаритмическими эффектами.
Таким образом, самый высокий уровень доказательной базы в отношении профилактики ВСС имеется у бета-блокаторов, которые следует назначать (при отсутствии противопоказаний) с целью первичной профилактики ВСС всем больным, перенесшим ОИМ, а также пациентам с систолической дисфункцией ЛЖ, как ишемического, так и неишемического генеза вне зависимости от аритмического анамнеза [1, 4, 12, 104–106].
С той же целью у больных, перенесших ИМ, назначаются иАПФ/ АРА, статины, аспирин, ω3-ПНЖК [107–109]. У больных с ХСН неишемического генеза обязательно назначение иАПФ/АРА, антагонистов альдостерона, ω3-ПНЖК [87].
Интервенционные методы
В этом подразделе обсуждаются современные возможности применения различных интервенционных методов в профилактике ВСС. Использование каждого из них имеет различный класс показаний и уровень доказательности и определяется нозологической формой основного заболевания, ФК сердечной недостаточности, состоянием систолической функции миокарда ЛЖ, клинической симптоматикой, наличием нарушений ритма.
ИКД
Современный имплантируемый кардиовертер-дефибриллятор (ИКД) представляет собой систему, состоящую из устройства, которое заключено в небольшой титановый корпус, который размещается подкожно или подфасциально в левой подключичной области и одного или более электродов, установленных в камерах сердца. На сегодняшний день применяются одно-, двух- и трехкамерные (бивентрикулярные) системы.
В большинстве аппаратов само устройство, заключенное в титановую коробку, является частью цепи разряда дефибриллятора [110] (рис. VI.1).
В основе детекции аритмий лежит анализ интервала R-R, формы желудочкового сигнала, стабильности RR-интервала, соотношения характеристик предсердной и желудочковой активности (в двухкамерных системах). Входящий сигнал проходит фильтрацию, в результате которой элиминируются и не подвергаются детекции низкочастотные (обусловленные Т-волной) и высокочастотные компоненты (обусловленные активностью скелетной мускулатуры).
В дефибрилляторах существуют различные зоны детекции частоты сердечных сокращений. Например, если частота аритмии попадает в т.н. зону фибрилляции желудочков (где частота сокращений желудочков превышает 200 в минуту), то происходит разряд дефибриллятора для терапии ФЖ или высокочастотной ЖТ (рис. VI.2). В т.н. зоне ЖТ возможно проведение различных видов антитахикардической желудочковой стимуляции для подавления аритмий. Так, гемодинамически незначимая, относительно медленная ЖТ, регистрируемая в низкочастотной зоне детекции, может быть успешно купирована антитахикардитической стимуляцией. ЖТ может быть купирована в режиме BURST (стимуляция короткими пачками импульсов с частотой, на 10–30% превышающей частоту тахикардии), RAMP (стимуляция импульсами с постепенно увеличивающейся частотой, при которой каждый последующий импульс укорачивает цикл стимуляции по сравнению с предыдущим) или RAMP+ (стимуляция одиночным сканирующим экстрастимулом, который наносится в зависимости от длины цикла тахикардии установленным интервалом сцепления). При их неэффективности выполняется кардиоверсия (рис. VI.3). В т.н. нормосистолической зоне (ЧСС находится в диапазоне 40–150 ударов в минуту) ИКД детектирует ритм, а в брадисистолической зоне (ЧСС ниже 40 ударов в минуту) аппарат осуществляет лектрокардиостимуляцию в запрограммированном врачом режиме.
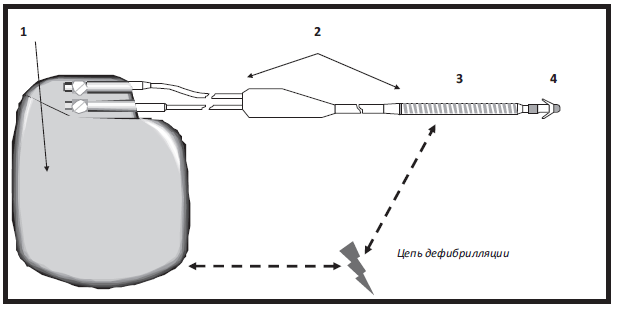
Рис. VI.1 Схема современных ИКД. Устройство состоит из титанового корпуса (1) и внутриседечного электрода (2). Цепь разряда ИКД заключена между корпусом устройства и катушкой (3), находящейся на электроде. С помощью дистального кончика электрода (4) осуществляется детекция аритмических событий и проведение антитахи- и антибради- электрокардиостимуляции
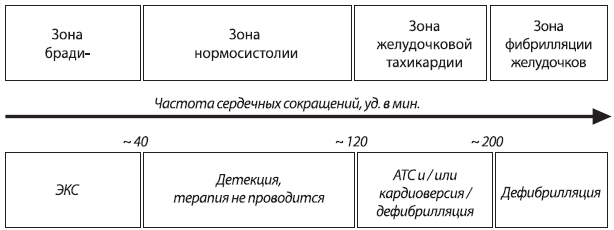
Рис. VI.2. Зоны детекции в ИКД. Представлена схема, отображающая зоны детекции в современных ИКД, в зависимости от частоты желудочковых сокращений. В т. н. брадисистоли
ческой зоне (ЧСС ниже 40 в минуту) проводится обычная ЭКС в установленном режиме; в т.н. нормосистоличекой зоне (ЧСС 40-150 в минуту) аппарат осуществляет лишь детекцию
событий и электрокардиотерапия не проводится; в т.н. зоне желудочковой тахикардии (ЧСС 150-200 в минуту) может проводится антитахикардическая ЭКС (АТС) или кардиоверсия; в зоне фибрилляции желудочков (при ЧСС 200 в минуту и выше) используется дефибрилляция
Параметры детекции и алгоритмы терапии для каждой зоны устанавливаются во время тестирования устройства с помощью программатора. В зависимости от клинической ситуации, проводимой медикаментозной терапии эти значения, в дальнейшем, могут корригироваться. Для предотвращения неоправданных разрядов во время суправентрикулярных аритмий, синусовой тахикардии применяются функции анализа стабильности RR интервала (при тахисистолической форме фибрилляции предсердий), морфологии эндографического желудочкового сигнала, регистрируемого желудочковым электродом. Существует возможность оценить внезапность начала тахиаритмии (при возникновении ЖТ или ФЖ величина интервала RR внезапно уменьшается), а также зарегистрировать эндографические сигналы в предсердиях и желудочках. Подбор терапии ИКД определяется врачом на основании переносимости больным клинической тахикардии. Так при гемодинамически значимой быстрой ЖТ или ФЖ первым шагом в терапии является дефибрилляция мощностью на 10 Дж превышающей интраоперационный порог дефибрилляции с последующим автоматическим нарастанием мощности разрядов до максимальных значений (40 Дж), а также изменением полярности в цепи дефибрилляции от корпуса ИКД к внутрисердечному электроду и наоборот [110].
Эффективность ИКД в отношении профилактики ВСС была доказана в нескольких крупных клинических исследованиях (таблица VI.1) дизайн которых предполагал оценку выживаемости у пациентов с наличием основных факторов риска ВСС, выделенных JT Bigger еще в 1984 г [24]. Результаты, полученные в этих исследованиях, легли в основу существующих сегодня Американских и Европейских рекомендаций по имплантации этих устройств и Рекомендаций по лечению желудочковых аритмий с целью профилактики ВСС [4].
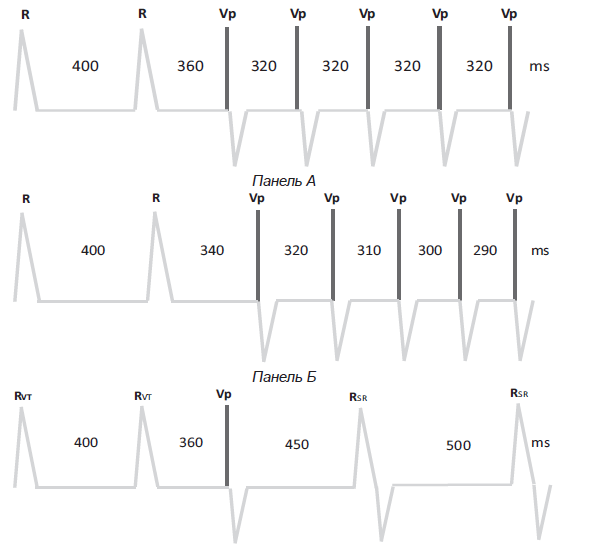
Рис. VI.3. Виды антитахикардитической стимуляции. На панеле А схематично представлен Burst режим АТС. Длина цикла ЖТ (интервал R-R) составляет 400 мс. АТС проводится с фиксированной длиной цикла (интервал Vp-Vp) 320 мс, составляющий 80% от длины цикла ЖТ. На панеле Б схематично представлен Ramp режим АТС. Длина цикла ЖТ (интервал R-R) составляет 400 мс. Проводится стимуляция импульсами с постепенно увеличивающейся частотой при которой каждый импульс укорачивает цикл стимуляции по сравнению с предыдущим на 10 мс. На панеле В схематично представлен Ramp+ или сканирующий режим АТС. Длина цикла ЖТ (интервал RVT-RVT) составляет 400 мс. Проводится стимуляция одиночным сканирующим экстрастимулом (Vp), который наносится в зависимости от длины цикла тахикардии. В данном примере сканирующий экстрастимул прерывает ЖТ
Таблица VI.1
Исследования по оценке ИКД в отношении первичной и вторичной профилактики ВСС
| Исследование, год публикации результатов | Цель исследования | Количество пациентов | Период наблюдения | Результаты |
|---|---|---|---|---|
| Вторичная профилактика ВСС | ||||
| AVID 1997 [25] | Сравнение ААТ и ИКД у лиц переживших сердечный арест | 1016 | 13 месяцев | Снижение общей летальности в подгруппе пациентов с ИКД на 29% |
| CASH 2000 [27] | Сравнение ААТ и ИКД у лиц переживших сердечный арест | 288 | 57 месяцев | В группе пациентов с ИКД общая летальность была на 23% ниже, аритмическая летальность уменьшилась на 61% |
| CIDS 2000 [26] | Сравнение ААТ амиодороном и ИКД у лиц переживших сердечный арест | 659 | 3 года | В группе пациентов с ИКД общая летальность была на 20% ниже, аритмическая летальность уменьшилась на 31% |
| Первичная профилактика | ||||
| MADIT 1996 [31] | Сравнение ИКД и ААТ у пациентов с ОИМ в анамнезе, ФВ менее 35%, НЖТ и индуцированной уст. ЖТ в ходе эндоЭФИ | 196 | 27 месяцев | Снижение общей летальности в подгруппе пациентов с ИКД на 54% |
| GABG-Patch 1997 [111] | Сравнение ИКД+АКШ и ААТ+АКШ у пациентов с ФВ ниже 35% в отношении влияния на общую летальность | 900 | 32 месяца | Показатели общей летальности не отличались между группами |
| MUSTT 1999 [33] | Сравнение ИКД, ААТ и базовой терапии ИБС у пациентов с ОИМ в анамнезе, ФВ менее 40%, НЖТ и индуцированной устойчивой ЖТ в ходе эндоЭФИ | 659 | 5 лет | Снижение общей летальности в подгруппе пациентов с ИКД на 31% и 24% в сравнении с группой ААТ и базовой терапии ИБС соответственно |
| MADIT II 2002 [32] | Сравнение ИКД и базовой терапии ИБС у пациентов с ОИМ в анамнезе, ФВ менее 30% | 1232 | 20 месяцев | Снижение абсолютного риска общей летальности в подгруппе пациентов с ИКД на 56% |
| CAT 2002 [112] | Сравнение базовой терапии ХСН и ее сочетания с ИКД у пациентов с ДКМП, ФВ менее 30% | 104 | 66 месяцев | Снижение абсолютного риска общей летальности в подгруппе пациентов с ИКД на 55% |
| AMIOVIRT 2003 [113] | Сравнение ИКД и амиодарона у пациентов с ДКМП, ФВ менее 35% и НЖТ | 103 | 24 месяца | Снижение абсолютного риска общей летальности в подгруппе пациентов с ИКД на 17% |
| DEFINITE 2004 [114] | Сравнение базовой терапии ХСН и ее сочетания с ИКД у пациентов с ДКМП, ФВ менее 36%, НЖТ и ЖЭ | 468 | 29 месяцев | Снижение абсолютного риска общей летальности в подгруппе пациентов с ИКД на 52% |
| DINAMIT 2004 [115] | Сравнение базовой терапии ОИМ и ее сочетания с имплантацией ИКД в подостром (от 6 до 40 дней) периоде ОИМ | 674 | 30 месяцев | Имплантация ИКД в подостром периоде ОИМ не уменьшает общую, но снижает аритмическую летальность |
| COMPANION 2004 [116] | Сравнение терапии ИКД в сочетании с кардиоресинхронизирующей терапией (CRT) с изолированной кардиоресинхронизирующей терапией или базовой терапией ХСН | 1520 | 12 месяцев | Снижение абсолютного риска общей летальности в подгруппе пациентов с ИКД-CRT на 36% |
| SCD-HeFT 2005 [34] | Сравнение ИКД, амиодарона и плацебо у пациентов с ХСН II–III по NYHA, ФВ менее 35%, (этиология: ИБС – 55%, ДКМП – 45%) | 2521 | 45 месяцев | Снижение общей летальности в подгруппе пациентов с ИКД на 23% |
Примечание: ИБС – ишемическая болезнь сердца; ЖЭ – желудочковая экстрасистолия;
ЖТ – желудочковая тахикардия; ДКМП – дилатационная кардиомиопатия; ФВ – фракция выброса; БЛНПГ – блокада левой ножки пучка Гиса; ИКД – имплантируемый кардиовертердефибриллятор; ЭхоКГ – эхокардиография; НУЖТ – неустойчивая желудочковая тахикардия; ОИМ – острый инфаркт миокарда; ХСН – хроническая сердечная недостаточность; ИКД-CRT – имплантируемый кардиовертер-дефибриллятор в сочетании с функцией кардиоресинхронизации.
Таким образом, новые подходы к проведению первичной профилактики ВСС требуют возможности осуществлять профилактическую дефибрилляцию у значительного числа пациентов. С практической точки зрения эта ситуация подразумевает возможное нанесение одного разряда у одного больного за относительно продолжительный период времени, например составляющий несколько лет. В этой связи клиническое использование новых ИКД-технологий, в разработке которых приняли участие, в том числе и отечественный ученные, приобретает важное клиническое значение [117–119].
РЧА
Катетерная РЧА является одной из интервенционных методик, способной эффективно устранить или модифицировать субстрат одного из главных факторов риска, а именно ЖТ и/или ФЖ. Целесообразность ее применения определяется этиологией аритмического синдрома, вариантом его течения. Проведение РЧА оправдано у пациентов с частыми шоковыми разрядами ИКД при развитии т.н. «электрического шторма» (более 3 оправданных шоковых разрядов ИКД в течение 24 часов), обусловленного устойчивой рецидивирующей ЖТ, рефрактерной к множественной ААТ [120–122]. Тем не менее, на сегодняшний день, данные об эффективности РЧА в отношении профилактики ВСС ограничены, во многом из-за того, что группа пациентов с ЖТ является неоднородной и проведение рандомизации у этой категории пациентов затруднено.
В связи с вышесказанным заслуживают внимания данные метаанализа 5 исследований по оценки эффективности РЧА ЖТ, опубликованные в 2012 г., в котором анализировались данные о 457 пациентах со структурной патологией сердца (в основном ишемического генеза) [67]. В исследовании проводился сравнительный анализ влияния РЧА и ААТ на течение аритмического синдрома и смертность (без уточнения ее механизма), оценивалась частота развития осложнений при проведении РЧА ЖА. Результаты мета-анализа показали, что РЧА ЖА достоверно приводит к снижению количества эпизодов ЖТ, количества эпизодов срабатывания ИКД. Тем не менее, проведение РЧА не сопровождается уменьшением смертности (в т.ч. и внезапной). При обсуждении полученных результатов авторы отдают себе отчет в том, что многие публикации, вошедшие в этот мета-анализ, имели описательный характер, а доля рандомизированных исследований была ограничена [123].
Несмотря на тот факт, что публикации, посвященные результатам РЧА неишемических ЖНР в т.ч. у пациентов с АДПЖ, ДКМП, каналопатиями свидетельствуют о положительном влиянии интервенционного вмешательства на течение аритмического синдрома, однозначно судить о роли РЧА в профилактике ВСС сегодня не представляется возможным. Число пациентов, принимавших участие в этих исследованиях относительно невелико, а периоды клинического наблюдения за ними были непродолжительными.
Таким образом, сегодня РЧА является наиболее эффективным методом лечения у пациентов с ЖНР и отсутствием структурной патологии сердца [4]. Улучшение гемодинамических параметров, озникающее после проведения РЧА идиопатической ЖЭ, может рассматриваться как важная позитивная модификация такого фактора риска ВСС как систолическая дисфункция [124]. Тем не менее, в эпоху оказательной медицины для подтверждения этого предположения необходимы данные рандомизированных исследований с длительным периодом наблюдения за этой категорией пациентов.
Хирургическое лечение аритмий
Методики прямого хирургического иссечения или резекции аритмогенного очага по-прежнему используются в ведущих хирургических центрах у пациентов с рецидивирующей ЖА, рефрактерной к множественной ААТ; у пациентов с ИКД и частыми шоковыми разрядами; у больных с неэффективностью от проведенной РЧА. Хирургическое лечение обусловливает необходимость тщательной предоперационной подготовки и интраоперационного определения источника или источников тахикардии. Для элиминации аритмогенных участков в ряде центров используют подход, основанный на резекции рубцовых полей в миокарде.
Поскольку такие вмешательства довольно травматичны, то используемые сегодня в клинической практике операции эндокардиальной резекции постинфарктного рубца, круговой эндокардиальной вентрикулотомии и эндовентрикулопластики, как правило, сочетаются с аорто-коронарным шунтированием. Во время хирургического вмешательства также могут использоваться эндокардиальная РЧА, криодеструкция очагов аритмии.
Таким образом, при рецидивирующей ЖТ на фоне терапии ИКД, рефрактерной к медикаментозной терапии и катетерной РЧА, возможна хирургическая резекция очага ЖТ или его прямая РЧА или криодеструкция.
У пациентов с врожденным синдромом удлиненного интервала QT (LQTS) выполнение левой шейно-грудной симпатической ганглиоэктомии используется как дополнительный метод лечения при частых эпизодах терапии ИКД или при непереносимости бета-блокаторов [126].
Реваскуляризация миокарда с целью лечения аритмий
Развитие ЖА напрямую связано с острой или хронической ИБС. В этой связи хирургическая или интервенционная реваскуляризация гибернирующего миокарда может улучшить электрическую стабиль. Таким образом, скрининговая диагностика и лечение ишемии сердца должны быть первыми этапами стратификации риска и профилактики ВСС, поскольку после реваскуляризация жизнеспособного миокарда может модифицировать такой основной фактор риска ВСС как сократительная дисфункция ЛЖ [127]. У ряда постинфарктных пациентов жизнеугрожающие ЖНР могут быть устранены реваскуляризацией миокарда, но только в том случае, если они провоцируются ишемией. Снизить частоту ЖТ/ФЖ в острый период инфаркта миокарда позволяет и ранняя реваскуляризация миокарда в сочетании с назначением бета-блокаторов.
Тем не менее, у значительного числа больных, несмотря на проведенную реваскуляризацию миокарда, риск развития ВСС в течение года составляет 13% [128]. Следует понимать, что у больных с большой площадью рубца восстановление ФВ ЛЖ менее вероятно, и имплантация ИКД может потребоваться уже вскоре после проведения реваскуляризации.
Обзор исследований, посвященных данной проблеме, свидетельствует о том, что реваскуляризация миокарда приводит к увеличению выживаемости и снижению частоты развития ВСС в отдаленном периоде наблюдения [129]. Если течение ИБС осложняется развитием ЖА, особенно у пациентов с поражением ствола левой коронарной артерии и проксимальных отделов передней межжелудочковой ветви, то существует высокая вероятность того, что реваскуляризация миокарда позволит снизить частоту развития и уменьшить тяжесть течения аритмического синдрома, а у некоторых пациентов полностью его устранит.
На наш взгляд отдельного внимания заслуживает вопрос проведения реваскуляризации у пациентов с ишемической этиологией ХСН без клинически ведущих проявлений стенокардии с целью первичной и вторичной профилактики ВСС. В отношении этой категории больных крайне ограничены данные о влиянии реваскуляризации не только на частоту ВСС, но и также на общую выживаемость.
В этом контексте диагностическое обследование больных с ХСН ишемического генеза должно включать и оценку жизнеспособности миокарда. Так в целом ряде проспективных и ретроспективных сследований, а также мета-анализов было продемонстрировано, что у больных с ишемизированным, но все еще жизнеспособным миокардом, после проведения реваскуляризации отмечается улучшение сократительной функции ЛЖ и характеристик выживаемости [127]. Напротив, у больных без жизнеспособного миокарда реваскуляризация неэффективна, а значит, следует избегать выполнения крайне рискованной операции. Стандартной методикой для оценки анатомии миокарда, его региональной и общей сократительной функции, жизнеспособности и, что еще важнее, размеров инфаркта и процента трансмурального поражения (определяемого с поздним гадолиниевым усилением) является ядерно-магнитный резонанс [130].
Выбор между основными методами прямой реваскуляризации (АКШ или интервенционная ангиопластикой) должен основываться на тщательной оценке анатомии коронарных поражений, ожидаемой «полноты» реваскуляризации, характера сочетанных заболеваний и наличия или отсутствия сопутствующего выраженного клапанного поражения сердца.
Тем не менее, проведение успешной реваскуляризации у больных ИБС с систолической дисфункцией, не снимает с повестки актуальность мероприятий по профилактике ВСС и имплантации ИКД [4, 12].
В таблицах VI.2 и VI.3 приводятся рекомендации для больных ХСН с систолической дисфункцией ЛЖ (ФВ≤35%) и преобладанием симптомов либо стенокардии, либо ХСН.
Таблица VI.2
Рекомендации для больных с хронической сердечной недостаточностью и систолической дисфункцией ЛЖ (ФВ ≤35%), с преобладанием симптомов стенокардии
| Класс показаний | Доказательность | |
|---|---|---|
| Выполнение ЧКВ возможно при подходящей анатомии и при наличии жизнеспособного миокарда. | IIb | C |
Таблица VI.3
Рекомендации для больных с хронической сердечной недостаточностью и систолической дисфункцией ЛЖ (ФВ ≤35%), с преобладанием симптомов сердечной недостаточности (стенокардии на уровне I-II класса или ее отсутствие)
| Класс показаний | Доказательность | |
|---|---|---|
| Выполнение ЧКВ возможно при подходящей анатомии и при наличии жизнеспособного миокарда. | IIb | C |
| В отсутствие доказанного наличия жизнеспособного миокарда реваскуляризация не рекомендуется. | III | B |
VII. СТРАТИФИКАЦИЯ РИСКА И ПРОФИЛАКТИКА ВСС ПРИ ОТДЕЛЬНЫХ НОЗОЛОГИЧЕСКИХ ФОРМАХ
VII.1. Стратификация риска и профилактика ВСС у пациентов с ИБС
VII.1.А. Стратификация риска и профилактика ВСС у пациентов с постинфарктным кардиосклерозом и систолической дисфункцией ЛЖ
Стратификация риска
Для определения риска развития ВСС и выбора мер ее профилактики у данной категории пациентов, прежде всего, необходимо составить представление о варианте клинического течения ИБС в каждом
конкретном случае (стабильный-нестабильный).
У пациентов с указаниями в анамнезе на перенесенный ранее (не менее 40 дней) инфаркт миокарда алгоритм стратификации риска ВСС представлен в таблице VII.1.1. Последовательная реализация алгоритма у данной категории пациентов предполагает выявление, прежде всего, основных факторов риска ВСС, что в конечном итоге, будет определять перечень мероприятий, необходимых для проведения первичной/вторичной профилактики ВСС в каждом конкретном клиническом случае.
Последовательная реализация представленного алгоритма у данной категории пациентов, предполагает прежде всего исключение нестабильного варианта течения ИБС, а также выявление основных факторов риска ВСС, что в конечном итоге, будет определять перечень мероприятий, необходимых для проведения первичной/вторичной профилактики ВСС в каждом конкретном клиническом случае.
Рекомендации по профилактике ВСС
В соответствии с принципами доказательной медицины ниже представлен перечень мероприятий, которые необходимо осуществлять для проведения профилактики ВСС у пациентов, имеющих указания в анамнезе на перенесенный инфаркт миокарда.
Класс I:
1. Адекватное медикаментозное лечение ИБС и ХСН, включающее
обязательное назначение (при отсутствии противопоказаний и неприемлемых побочных эффектов) следующих групп препаратов:
• бета-блокаторы (А)
• иАПФ (А)
• ацетилсалициловая кислота (А)
• статины (А)
• эплеренон после ИМ при сниженной ФВ ЛЖ в сочетании с левожелудочковой недостаточностью или сахарным диабетом (B)
• ПНЖК (B)
2. Восстановление коронарного кровотока хирургическим или интервенционным методами при возможности проведения этой коррекции (С).
3. В целях вторичной профилактики ВСС ИКД-терапия рекомендована пациентам, выжившим после ФЖ или гемодинамически нестабильной ЖТ (основные факторы риска), которые не были связаны с обратимыми причинами и которые получают постоянную оптимальную медикаментозную терапию, имеют хороший функциональный статус* и благоприятный прогноз выживания в течение года и более (А).
Таблица VII.1.1
Стратификация риска ВСС у пациентов с постинфарктным кардиосклерозом и систолической дисфункцией ЛЖ
| 1. Есть ли верифицированный эпизод сердечного ареста вследствие ФЖ/ЖТ? | ||
| Да | Нет | |
| См. пункт 2 | ||
| 2. Есть ли стенокардия и/или признаки дестабилизации* течения ИБС? | ||
| Да | Нет | |
| Коронарография, обсуждать возможность реваскуляризации | См. раздел рекомендации по профилактике ВСС | |
| 3. Есть ли зарегистрированные неустойчивые желудочковые нарушения ритма** | ||
| Да | Нет | |
| ХМ-ЭКГ, обсуждать проведение КАГ, эндоЭФИ | См. пункт 4 | |
| 4. Есть ли клинико-инструментальные признаки хронической аневризмы левого желудочка? | ||
| Да | Нет | |
| Обсуждать кардиохирургическое лечение | См. пункт 5 | |
| 5. ФВ ЛЖ менее 40% | ||
| Да | Нет | |
| См. раздел профилактика ВСС | См. раздел стратификация риска и методы профилактики ВСС у пациентов с хронической ИБС и сохранной систолической функцией ЛЖ | |
* – под термином дестабилизация течения ИБС понимают нестабильную стенокардию (согласно определению Национальных рекомендаций по лечению ОКС без стойкого подъема ST на ЭКГ) стенокардию III-IV ФК при отсутствии эффекта от адекватно проводимой антиангинальной терапии, стенокардию возникшую после проведения мероприятий по реваскуляризации миокарда (стентирование, АКШ).
** – под термином неустойчивые ЖНР понимаются неустойчивая ЖТ (НЖТ) и ЖЭ.
4. В целях первичной профилактики ВСС ИКД-терапия рекомендована пациентам с наличием такого основного фактора риска ВСС как дисфункция ЛЖ, обусловленная предшествующим ИМ (не менее чем 40 дней после ИМ), с ФВ ЛЖ ниже 40%, с ХСН І–ІІІ ФК по классификации NYHA, с хорошим функциональным статусом, получающим постоянную оптимальную медикаментозную терапию и имеющим благоприятный прогноз выживания в течение года и более (А).
5. В целях первичной профилактики ВСС ИКД-терапия рекомендована пациентам с с наличием таких основных факторов риска ВСС как дисфункция ЛЖ, обусловленная предшествующим ИМ (не менее чем 40 дней после ИМ), с ФВ ЛЖ ниже 40%, с ХСН І–ІІІ ФК по классификации NYHA, с неустойчивой ЖТ (по данным ЭКГ, ХМ-ЭКГ) и устойчивой ЖТ и/или ФЖ (индуцированной в ходе эндоЭФИ), с хорошим функциональным статусом, получающим постоянную оптимальную медикаментозную терапию и имеющим благоприятный прогноз выживания в течение года и более (А).
Класс IIа:
1. Амиодарон в сочетании с бета-блокаторами у пациентов с наличием такого основного фактора риска ВСС как симптоматичные ЖНР при отсутствии эффекта от изолированного приема бета-блокаторов (B).
2. Соталол у пациентов с ЖНР (основной фактор риска ВСС) при
отсутствии эффекта от приема бета-блокаторов (C).
3. Проведение хирургического лечения хронической аневризмы
сердца (C).
4. РЧА ЖТ у пациентов с ИКД и ААТ при частых (более 2 раз в год)
эпизодах оправданной терапии ИКД (C).
Класс IIb:
1. РЧА у пациентов с гемодинамически стабильной ЖТ (основной
фактор риска ВСС) и ФВ более 40% (B).
2. Амиодарон у пациентов с ЖТ (основной фактор риска ВСС), которые не переносят и/или отказываются получать терапию ИКД (C).
Класс III:
1. Назначение ААТ не является обязательным у пациентов с асимптомными ЖЭ или неустойчивой ЖТ (основной фактор риска ВСС) (B).
2. ААТ IC класса противопоказаны (A).
3. Назначение амиодарона не рекомендуется пациентам с тиреотоксикозом (С).
VII.1.Б. Стратификация риска и методы профилактики ВСС у пациентов с хронической ИБС и сохранной систолической функцией ЛЖ
Стратификация риска
Следует понимать, что любой пациент с верифицированным диагнозом ИБС потенциально относится к группе риска ВСС, а большинство внезапных смертей в абсолютных значениях приходится на категорию лиц без выраженной систолической дисфункции миокарда ЛЖ [9–12, 19].
У этой группе пациентов ключевое значение приобретает верификация и последующая модификация второстепенных факторов риска ВСС, которые, по сути, являются и факторами риска ИБС. Таким образом, проведение диагностических тестов и назначение медикаментозной терапии (вторичная профилактика ИБС), регламентированное Национальными Рекомендациями по диагностике и лечению хронической ИБС, по сути, являются мероприятиями по стратификации риска и профилактике ВСС [131].
Появление различных вариантов ЖА у пациентов с хронической ИБС зачастую может быть связано с дестабилизацией течения ИБС и/ или прогрессированием ХСН.
В большинстве случаев пробежки НЖТ у пациентов с хронической формой ИБС бессимптомны. До настоящего времени не существует общепринятых данных о том, что ее подавление достоверно увеличивает выживаемость. Лечение устойчивой ЖТ у пациентов с хронической формой ИБС определяется ее клиническими проявлениями и частотой ее возникновения. У пациентов, с указаниями в анамнезе на эпизод сердечного ареста вследствие ФЖ/ЖТ, который развился после 48 ч от начала ОИМ, имеется высокий риск возникновения повторного эпизода ФЖ [132–134].
Таблица VII.1.2
Стратификация риска ВСС у пациентов с хронической ИБС и сохранной систолической функцией ЛЖ
| 1. Есть ли преходящая или постоянная ишемия миокарда и/или повторные острые коронарные эпизоды? | |
| Да | Нет |
| Коронарография с целью выбора метода реваскуляризации | См. пункт 2 |
| 2. Есть ли зарегистрированные устойчивые/неустойчивые желудочковые нарушения ритма? | |
| Да | Нет |
| Коронарография с целью выбора метода реваскуляризации | См. рекомендации по диагностике и лечению хронической ИБС[131] |
Для определения риска ВСС и выбора тактики лечения у данной категории пациентов необходимо учитывать клиническую картину заболевания и верифицировать возможные причины развития ЖНР. Алгоритм стратификации риска представлен в таблице VII.1.2.
Рекомендации по профилактике ВСС
Класс I:
1. Адекватное медикаментозное лечение ИБС и ХСН, включающее обязательное назначение (при отсутствии противопоказаний и побочных эффектов) следующих групп препаратов:
• бета-блокаторы (А)
• иАПФ (А)
• ацетилсалициловая кислота, (А)
• статины (А)
• ПНЖК (B)
2. В целях вторичной профилактики ВСС пациентам, выжившим
после ФЖ или гемодинамически нестабильной ЖТ (основные факторы риска), при наличии показаний рекомендовано восстановление проходимости коронарных артерий, так как острая ишемия миокарда, как правило, провоцирует ЖТ (В).
3. В целях вторичной профилактики ВСС ИКД-терапия рекомендована пациентам, выжившим после ФЖ или гемодинамически нестабильной ЖТ (основные факторы риска), при отсутствии возможности восстановления коронарного кровотока, которые получают постоянную оптимальную медикаментозную терапию, имеют хороший функциональный статус* и благоприятный прогноз выживания в течение года и более (А).
Класс ІІа
1. Терапия амиодароном в сочетании с β-адреноблокаторами целесообразна для уменьшения выраженности симптомов, обусловленными такими основными факторами риска ВСС как рецидивирующая гемодинамически стабильная ЖТ у пациентов с дисфункцией ЛЖ, обусловленной перенесенным ОИМ, которым не может быть имплантирован ИКД или они отказываются от проведения операции имплантации (С).
2. В целях первичной профилактики ВСС восстановление коронарного кровотока хирургическим и/или интервенционным методом при возможности его проведения показано пациентам с хронической ИБС и наличием
гемодинамически значимых стенозов коронарных артерий (С).
3. Имплантация ИКД целесообразна при лечении рецидивирующей устойчивой ЖТ у пациентов с перенесенным ранее ОИМ (основные факторы риска ВСС) с нормальной или близкой к нормальной систолической функцией желудочков, получающих постоянную оптимальную лекарственную терапию и имеющих благоприятный прогноз для выживания с хорошим функциональным состоянием в течение года и более (С).
Класс ІІb
1. Радиочастотная катетерная абляция или назначение амиодарона может рассматриваться как альтернатива установке ИКД у пациентов с умеренной дисфункцией ЛЖ (ФВ более 40%) и наличием такого основного фактора риска ВСС как рецидивирующая гемодинамически стабильная ЖТ (В).
Класс ІІІ
1. Не рекомендуется назначение ААТ в профилактических целях для снижения смертности у пациентов с неустойчивыми бессимптомными ЖА (основной фактор риска ВСС) (В).
VII.2. Стратификация риска и профилактика ВСС у пациентов с хронической сердечной недостаточностью
Сердечная недостаточность – патологическое состояние, при котором сердечный выброс не соответствует потребности организма вследствие снижения насосной функции сердца. В клинической практике различают острую и хроническую сердечную недостаточность. Сердечная недостаточность не является самостоятельным заболеванием. Как правило, она – осложнение или результат различных заболеваний и состояний.
У пациентов с хронической сердечной недостаточностью, сопровождающейся снижением систолической функции, часто встречаются ЖА и повышен риск ВСС. Этиология ХСН вероятно оказывает влияние на различные механизмы и виды ЖА. Дополнительными предикторами ВСС у больных ХСН являются выраженная митральная регургитация, снижение уровня гемоглобина и сопутствующая ХПН, с прогрессивным увеличением риска ВСС на стадии хронического диализа [135–138]. Из инструментальных показателей наибольшей прогностической ценностью у больных ХСН обладают ФВ, длительность комплекса QRS, наличие блокады левой ножки пучка Гиса, сигнал-усредненная ЭКГ, вариабельность ритма сердца, патологиче50 Vii . Стратификация риска и профилактика всс Vii . Стратификация риска и профилактика всс 51 ские изменения барорефлекса, альтернация зубца Т, дисперсия интервала QT, турбулентность сердечного ритма [139].
Стратификация риска
Для определения риска развития ВСС и выбора мер ее профилактики у данной категории пациентов необходимо составить представление о генезе ХСН в каждом конкретном клиническом случае.
В таблице. VII.2.1 представлен алгоритм стратификации риска ВСС у пациентов с ХСН. Последовательная реализация данного алгоритма позволит определить перечень мероприятий, необходимых для проведения первичной/ вторичной профилактики ВСС в каждом конкретном клиническом случае.
Рекомендации по профилактике ВСС
Класс I
1. Адекватное медикаментозное лечение ХСН согласно текущим Национальным Рекомендациям по лечению ХСН [83], включающее обязательное назначение (при отсутствии противопоказаний и побочных эффектов) бета-блокаторов (А), иАПФ (А), антогонистов альдестерона (А)
2. В целях вторичной профилактики ВСС ИКД-терапия рекомендована пациентам, выжившим после ФЖ или гемодинамически нестабильной ЖТ (основные факторы риска), которые не были связаны с обратимыми причинами и которые получают постоянную оптимальную медикаментозную терапию, имеют хороший функциональный статус* и благоприятный прогноз выживания в течение года и более (А).
Таблица VII.2.1
Стратификация риска ВСС у пациентов с ХСН
| 1. Имеются ли данные об ишемическом генезе ХСН? | |
| Да | Нет |
| Коронарография, обсуждать возможность реваскуляризации | См. пункт 2 |
| 2. Есть ли указания в анамнезе на эпизод сердечного ареста? | |
| Да | Нет |
| (см. рекомендации по профилактике ВСС – класс I, пункт 1) | Меры профилактики будут определяться: • ФК ХСН по NYHA, • величиной ФВ ЛЖ, • наличием /отсутствием ЖА • наличием /отсутствием признаков десинхронизации желудочков (см. рекомендации по профилактике ВСС) |
| 3. Имеются зарегистрированные устойчивые/неустойчивые желудочковые нарушения ритма? | |
| Да | Нет |
| ХМ-ЭКГ, обсуждать проведение эндоЭФИ | См. рекомендации по профилактике ВСС |
3. В целях первичной профилактики ВСС ИКД-терапия рекомендована пациентам с наличием такого основного фактора риска как дисфункция ЛЖ, обусловленная предшествующим ИМ (не менее чем 40 дней после ИМ), с ФВ ЛЖ ниже 40%, с ХСН І–ІІІ ФК по классификации NYHA, с хорошим функциональным статусом*, получающим постоянную оптимальную медикаментозную терапию и имеющим благоприятный прогноз выживания в течение года и более (А).
4. В целях первичной профилактики ВСС ИКД-терапия рекомендована пациентам с неишемическими заболеваниями сердца, имеющим ФВ ЛЖ менее 35%, ХСН ІІ–ІІІ ФК по классификации NYHA (основной фактор риска), получающим постоянную оптимальную лекарственную терапию, с хорошим функциональным статусом* и имеющим благоприятный прогноз выживания в течение года и более (А).
5. Сопутствующая терапия амиодароном, соталолом в виде монотерапии или в сочетании с β-адреноблокаторами с целью уменьшения симптомов ЖТ (как устойчивой, так и неустойчивой) рекомендована пациентам с имплантированными ИКД, получающим терапию по поводу ХСН (С).
6. Амиодарон показан пациентам с целью лечения гемодинамически значимых ЖТ и НЖТ в случае, если кардиоверсия и/или коррекция причин возникновения аритмии не смогли устранить или предотвратить ее ранний рецидив (В).
Класс IIa
1. В целях первичной профилактики ВСС ИКД-терапия, комбинированная с бивентрикулярной ЭКС, показана пациентам с ХСН III–IV ФК по классификации NYHA (основной фактор риска), получающим оптимальную лекарственную терапию, у которых длительность комплекса QRS на фоне синусового ритма превышает 120 мс, которые имеют хороший функциональный статус* и благоприятный прогноз выживания в течение года и более (В).
2. ИКД-терапия показана пациентам с рецидивирующей гемодинамически стабильной ЖТ (основной фактор риска), нормальной или почти нормальной ФВ ЛЖ, получающим оптимальное лечение ХСН с хорошим функциональным статусом* и имеющим благоприятный прогноз выживания в течение года и более (С).
3. Бивентрикулярная ЭКС без функции ИКД целесообразна для предотвращения ВСС у пациентов с ХСН III–IV ФК по NYHA, ФВ ЛЖ менее 35% (основные факторы риска), длительностью комплексов QRS 160 мс (или по меньшей мере 120 мс при наличии других признаков асинхронного сокращения желудочков), получающих постоянную оптимальную лекарственную терапию, с хорошим функциональным статусом и имеющих благоприятный прогноз выживания в течение года и более (В).
Класс IIb
1. Амиодарон и/или бета-блокаторы могут быть назначены пациентам с основными и второстепенными факторами риска ВСС, получающим оптимальное лечение по поводу ХСН, которым невозможно имплантировать ИКД.
2. В целях первичной профилактики ВСС ИКД-терапия может обсуждаться у пациентов с неишемическими заболеваниями сердца, имеющих ФВ ЛЖ от 30 до 35% (основной фактор риска), ХСН І ФК по классификации NYHA, получающих постоянную оптимальную лекарственную терапию, с хорошим функциональным статусом* и имеющих благоприятный прогноз выживания в течение года и более (В).
Класс III
1. Назначение препаратов IC класса для лечения ЖА (основной фактор риска ВСС) не рекомендуется у пациентов с ХСН (А).
2. ИКД-терапия не показана пациентам с рефрактерной ХСН, у которых не предполагается достижение компенсации ее проявлений и благоприятного прогноза (А)
Так как на долю ВСС приходится около 50% смертей у больных с ХСН, то чрезвычайно важным вопросом является первичная профилактика ВСС. Иными словами врач должен четко представлять на каком этапе течения заболевания пациенту нужно рекомендовать имплантацию ИКД. В таблице VII.2.2. представлены классы показания к имплантации ИКД в целях первичной профилактики в зависимости от генеза ХСН, ФК ХСН, величины ФВ ЛЖ и наличия ЖА.
VII.3. Стратификация риска и профилактика ВСС у пациентов с брадисистолических нарушениях ритма и проводимости
Под термином брадиаритмии понимают широкий спектр заболеваний, патогенез развития которых предполагает, в том числе, снижение системного выброса в результате уменьшения ЧСС вследствие нарушения импульсообразования в синусовом узле и/или распространения фронта деполяризации по структурам проводящей системы сердца. Реализация ВСС по брадиаритмическому сценарию происходит в 15% случаев [6–8]. Важно понимать, что факт наличия брадиаритмий, особенно в сочетании с систолической дисфункцией ЛЖ, предполагает, тем не менее, высокий и умеренный риск развития желудочковых тахиаритмий у одного и того же пациента.
VII.3.А. Стратификация риска и профилактика ВСС у пациентов с дисфункцией синоатриального узла (САУ)
На долю пациентов с синдромом слабости синусового узла (СССУ) приходится около половины от общего числа всех имплантаций ЭКС [140].
В отношении ВСС у данной категории пациентов прогноз будет определяться выраженностью клинических проявлений и природой основного заболевания. Считается, что проведение постоянной ЭКС улучшает клиническую симптоматику, но не модифицирует прогноз у пациентов с СССУ. Однако эти данные были получены достаточно давно при проведении небольших, нерандомизированных и непроспективных исследований [141]. Известно, что отсутствие постоянной ЭКС у пациентов с СССУ сопровождается ухудшением качества жизни, повышением заболеваемости и смертности. Что касается ВСС, то систематическая оценка ее вклада в долю летальных исходов у этих пациентов не проводилась [142].
Таблица VII.2.2 (Bradley, 2009)
Применение ИКД для первичной профилактики ВСС у пациентов с ХСН
| ФК по NYHA | Значение ФВ ЛЖ,% | |||||
| Менее 30 | 31–35 | 36–40 | ||||
| Генез ХСН | ||||||
| Ишемический | Неишемический | Ишемический | Неишемический | Ишемический | Неишемический | |
| NYHA I | I ( не ранее 40 дней после ОИМ) | IIb | I (НЖТ +) | IIb | I (НЖТ +) | III |
| NYHA II | I ( не ранее 40 дней после ОИМ) | I | I ( не ранее 40 дней после ОИМ) | I | I (НЖТ +) | III |
| NYHA III | I ( не ранее 40 дней после ОИМ) | I | I ( не ранее 40 дней после ОИМ) | I | I (НЖТ+) | III |
| NYHA IV | III | III | III | III | III | III |
Примечание: Римскими цифрами в таблице показан класс показаний к имплантации ИКД. ФВ ЛЖ – фракция выброса левого желудочка, ХСН – хроническая сердечная недостаточность, НЖТ – неустойчивая желудочковая тахикардия, ОИМ – острый инфаркт миокарда, ФК – функциональный класс.
Стратификация риска
Дисфункция САУ, приводящая к выраженной брадикардии или паузам, может проявляться обмороком, предобмороком, головокружением, гипотензией, прогрессией проявлений сердечной недостаточности, стенокардией. ВСС у пациентов с СССУ более вероятна при наличии признаков систолической дисфункции миокарда ЛЖ.
Патофизиологическим механизмом подобного сценария является длительная пауза асистолии без замещающего ритма и/или ЖА, развивающиеся в результате паузо-зависимых нарушений реполяризации, манифестация которых, сопровождается нарушениями как системной, так и регионарной гемодинамики, прежде всего со стороны ЦНС. Следствием чего является вероятное возникновение необратимых изменений со стороны жизненноважных органов и развитие летального исхода. Наличие или отсутствие предсуществующей структурной патологии сердца может иметь определяющее значение для адаптационных изменений параметров сердечного выброса, а значит для характера клинического течения аритмии. К сожалению, на сегодняшний день общепринятых факторов риска развития ВСС у пациентов с СССУ нет. Тем не менее, указания в анамнезе на такие факторы риска как эпизоды синкопе, наличие структурной патологии сердца, длительные симптоматичные паузы асистолии при проведении ХМ-ЭКГ кореллируют с неблагоприятным прогнозом, в том числе и в отношении ВСС. При этом следует иметь в виду, что ключевое значение имеет симптоматическая значимость паузы, а не ее длительность (см. таблицу V.2).
Профилактика ВСС
Проведение постоянной предсердной и/или двухкамерной ЭКС в соответствии с Национальными Рекомендациями по проведению ЭКС [70] у пациентов с СССУ улучшает симптоматику и качество жизни, уменьшает заболеваемость и частоту развития фибрилляции предсердий. Отдаленные результаты применения постоянной ЭКС и ее влияние на выживаемость и на частоту развития ВСС, на сегодняшний день, неизвестны.
VII.3.Б. Стратификация риска и профилактика ВСС у пациентов с нарушениями АВ- и внутрижелудочковой проводимости
Течение заболеваний, сопровождающихся нарушениями АВ- и внутрижелудочковой проводимости, оценивалось в нескольких нерандомизированных и обсервационных исследованиях [143, 144], в которых было установлено, что данные состояния часто ассоциируются с синкопе и пресинкопе и редко – с ВСС. Проведение постоянной ЭКС приводит к улучшению качества жизни, а что касается ВСС, то были получены неоднозначные данные.
Нарушения АВ-проведения
Благоприятный прогноз характерен для пациентов с АВ-блокадойI степени и II степени (Мобиц 1), тогда как при АВ-блокаде II степени (Мобиц 2), при развитии интрагисиальной или инфрагисиальной блокад отмечается прогрессирование нарушений проводимости в АВ-блокаду III степени (см. таблицу V.2), что требует проведения постоянной ЭКС [110].
АВ-блокада III степени чаще всего встречается при ИБС или дегенеративных заболеваниях сердца. В нескольких небольших нерандомизированных исследованиях было показано, что постоянная ЭКС увеличивает характеристики выживаемости у этих пациентов [110].
Двух- и трехпучковые блокады
Данные, полученные в проспективных исследованиях у асимптоматичных пациентов с хронической двухпучковой блокадой, свидетельствуют об относительно медленном прогрессировании заболевания в АВ-блокаду III степени [110]. Тем не менее, у этой категории пациентов отмечается относительно частое развитие ВСС, связанное с возникновением локачественных желудочковых тахиаритмий. Факторами риска ВСС являются – ИБС, ХСН и/или преклонный возраст [145]. Известно, что у пациентов с двух- и трехпучковой блокадой, у которых имеются указания в анамнезе на эпизоды синкопе, а также у пациентов с интермитирующей АВ-блокадой III степени чаще развивается ВСС. Проведение постоянной ЭКС незначительно уменьшает частоту ее возникновения [146]. Существуют противоречивые данные о прогностическом значении удлиненного интервала HV в отношении риска развития ВСС вследствие брадиаритмий. Так, в частности, верификации интервала HV>75 мс является слабым прогностическим признаком, а его увеличение более 100 мс свидетельствует о наличии крайне высокого риска и требует незамедлительного начала проведения постоянной ЭКС [147–149].
Роль блокад ножек системы Гиса–Пуркинье как независимого предиктора ВСС также неоднозначна. Предполагается, что присоединение блокады одной из ножек пучка Гиса приравнивается к возникновению дополнительного прогностического фактора риска ВСС.
У пациентов без выраженной структурной патологии сердца факт наличия или появления блокады одной из ножек пучка Гиса не ассоциируется с ухудшением прогноза в отношении ВСС. С другой стороны, для пациентов, перенесших ОИМ, которым проводилась тромболитическая терапия, наличие или присоединение блокад ножек в системе Гиса–Пуркинье является дополнительным фактором, обуславливающим риск развития ВСС [150–152].
Врожденная АВ-блокада
В ряде исследований было показано, что имплантация ЭКС может улучшить выживаемость у пациентов с врожденной полной поперечной блокадой [153–155]. ВСС может быть первой манифестацией врожденной полной поперечной блокады у ранее асимптомных пациентов без структурных заболеваний сердца. Механизмами ВСС у данной категории пациентов могут являться как эпизоды полной поперечной блокады с отсутствием какого-либо замещающего ритма, так и брадизависимые злокачественные желудочковые тахиаритмии.
У данной категории пациентов увеличение интервала QT, наличие ранних постдеполяризаций и дисперсия рефрактерности миокарда желудочков способствуют возникновению фатальных ЖНР, реализуемых по механизму long–short *(длинная-короткая последовательность) [156, 157]. У пациентов с врожденной патологией проводящей системы сердца к факторам риска ВСС относятся: наличие ЧСС менее 50 в минуту, удлинение интервала QT, наличие структурной патологии сердца [5].
АВ-блокада после РЧ-абляции или РЧ-модификации АВ-соединения
Проблема ВСС является актуальной у пациентов, перенесших РЧА АВ-соединения, в том числе в варианте РЧ-модификации АВ-соединения, так как у этой категории больных злокачественные ЖНР возникают в 2–3% случаев, особенно у лиц с выраженными проявлениями ХСН [5, 159]. Механизм озлокачествления аритмического синдрома в этой когорте пациентов остается до конца неясным. Считается, что имеет значение брадизависимое увеличение времени реполяризации желудочков и характеристик их рефрактерности в первые сутки после проведения радиочастотной абляции или модификации АВ-соединения, и особенно в тех случаях, когда нарушения реполяризации имелись исходно [160]. Профилактика ВСС в этих случаях заключается в проведении ЭКС с относительно высокой частотой и ЭКГ-мониторирования первые 24 часа после проведения данного интервенционного вмешательства.
По данным Zehender et al. после имплантации ЭКС 12–31% пациентов умирают внезапно в течение последующего периода наблюдения [161]. Авторы также отметили тот факт, что в течение первого года после имплантации ЭКС частота развития ВСС была в три раза выше, чем в последующие годы. Это согласуется с отечественными данными, свидетельствующими о 10%-й частоте возникновения ВСС после имплантации ЭКС и проведения РЧА АВ-соединения у пациентов с хронической формой фибрилляции предсердий [110, 202].
Предполагается, что нарушения чувствительности устройства или проведение стимуляции в асинхронном режиме способствует инициации злокачественных ЖНР [110].
Отдельную группу риска представляют больные с АВ-узловой реципрокной тахикардией (АВУРТ) на фоне предсуществующей АВ-блокады I степени. РЧ-модификация АВ-соединения, имеющая целью элиминацию АВУРТ, в этих случаях может быть связана с риском усугубления нарушений АВ-проведения, и возможно, ВСС. Методика РЧ-модификации АВ-соединения, разработанная отечественными
авторами, позволяет исключить этот риск [158].
Рекомендации по профилактике ВСС
Проведение постоянной двухкамерной ЭКС в соответствии с Национальными рекомендациями по проведению ЭКС [70] у пациентов с нарушениями АВ-проведения улучшает симптоматику и качество жизни, уменьшает заболеваемость. Данные о влиянии постоянной ЭКС в отдаленном периоде наблюдения на выживаемость и вероятность развития ВСС, на сегодняшний день, противоречивы.
VII.4. ВСС при кардиомиопатиях
Под кардиомиопатиями понимают заболевания миокарда, при которых фиксируются структурные и/или функциональные нарушения в отсутствие коронарного атеросклероза, гипертонии, врожденных или приобретенных пороков сердца. Кардиомиопатии принято разделять по морфологическим признакам на гипертрофическую, дилатационную и рестриктивную КМП, аритмогенную дисплазию правого желудочка, а также неклассифицируемую форму. В свою очередь, каждый из видов подразделяется на семейную или генетически обусловленную форму и на несемейную форму.
VII.4.A. Стратификация риска и профилактика ВСС у пациентов c ДКМП
Дилатационая кардиомиопатия (ДКМП) – группа заболеваний фенотипически объединенных наличием нарушения систолической функции левого желудочка и его дилатации, которые развиваются не вследствие гемодинамической перегрузки (из-за порока или гипертонии) и не вследствие ИБС. При этом расширение правого желудочка может также фиксироваться, но это не является диагностическим критерием ДКМП. Выделяют семейную форму с известной мутаций и семейную форму с неизвестным типом мутации. Среди несемейных форм выделяют ДКМП вследствие миокардита, болезнь Кавасаки, ДКМП ассоциированную с беременностью, эндокринные ДКМП, алкогольную, тахикардитическую формы, ДКМП вследствие чрезмерного употребления селена, карнитина, тиамина и т.п.
Пятилетняя выживаемость среди европеоидной расы при ДКМП до внедрения современных интервенционных методов лечения составляла 31,4% [164]. Смертность от данной патологии увеличивается от 0,10 до 1,16 на 10 000 среди мужчин в возрасте от 35–39 до 55–57 лет [165]. При этом на долю ВСС приходится 20% случаев смерти [166, 167].
ВСС довольно редко служит первым проявлением заболевания, чаще встречается у пациентов с признаками прогрессирующего течения заболевания [168, 169]. В большинстве случаев к эпизодам ВСС приводят жизнеугрожающие ЖА [170].
Генетический анализ
Целесообразно обследовать родственников первой линии родства, особенно в случае злокачественного течения ДКМП и при наличии патологического фенотипа, позволяющего заподозрить генетическую мутацию [171]. На основе имеющихся данных генетический анализ на выявление мутации в гене LMNA может играть роль в стратификации риска ВСС при ДКМП [172, 173]. Однако в большинстве случаев, мутационный скрининг пробанда обладает низкой эффективностью (менее 20% при изолированной ДКМП без сопутствующего поражения скелетной мускулатуры) [171]. Стандартный набор методик при обследовании включает семейный анамнез не менее трех поколений (с оценкой случаев ХСН, ДКМП, трансплантации сердца, ВСС, нарушений сердечного ритма и проводимости, инсульта или других тромбоэмболических осложнений), а также физикальный осмотр, ЭКГ, Эхо-КГ, ХМ-ЭКГ (в случае ВСС пробанда).
Рекомендации по генетическому тестированию
Класс I
1. У всех пациентов с ДКМП рекомендуется тщательное изучение семейного анамнеза не менее чем в 3-х поколениях (А)
2. Рекомендуется кардиологический скрининг родственников первой линии родства: анамнез, осмотр, ЭКГ, ЭХО-КГ, ХМ-ЭКГ (в случае смерти пробанда) (А)
3. При выявлении у родственников признаков ДКМП – рекомендуется регулярное кардиологическое обследование начиная с раннего детства (при ламинопатиях с 10–12 лет) каждые 12–36 месяцев до 10 лет, каждые 12–24 месяцев до 20 лет и далее каждые 2–5 лет до 50–60 лет и кардиологический скрининг потомков пробанда каждого последующего поколения (B)
4. Если признаки ДКМП у родственников не обнаружены и генетическое тестирование невозможно, рекомендуется регулярное кардиологическое обследование начиная с раннего детства каждые 12–36 месяцев до 10 лет, каждые 12–24 месяцев до 20 лет и далее каждые 2–5 лет до 50–60 лет. (B)
5. При выявлении у пробанда с ДКМП в результате генетического тестирования причинной мутации рекомендуется генетический скрининг родственников первой линии родства (В).
6. Если причинные мутации у родственников отсутствуют, следует прекратить дальнейшее обследование (С).
7. Если причинные мутации у родственников отсутствуют, не следует проводить генетическое тестирование потомков (С).
Класс IIa
1. При выявлении причинных мутаций у родственников бессимптомных носителей причинных мутаций рекомендуется регулярное кардиологическое обследование ежегодно с 10 до 20 лет и далее каждые 1–3 года с использованием дополнительных методов обследования при необходимости (С).
Стратификация риска
Подходы к стратификации риска ВСС у пациентов с ДКМП не отличаются от тех, которые используются при стратификации риска у пациентов с ХСН неишемического генеза (см. таб. VII.2.1). При ДКМП крайне высокий риск ВСС ассоциирован с мутациями в гене LMNA Рекомендации по профилактике ВСС
Класс I
1. Адекватное медикаментозное лечение ХСН согласно текущим Национальным Рекомендациям по лечению ХСН [87], включающее обязательное назначение (при отсутствии противопоказаний и побочных эффектов) бета-блокаторов (А), иАПФ (А), антагонистов альдестерона (А).
2. В целях вторичной профилактики ВСС ИКД-терапия рекомендована пациентам, выжившим после ФЖ или гемодинамически нестабильной ЖТ (основные факторы риска), которые не были связаны с обратимыми причинами и которые получают постоянную оптимальную медикаментозную терапию, имеют хороший функциональный статус* и благоприятный прогноз выживания в течение года и более (А).
3. В целях первичной профилактики ВСС ИКД-терапия рекомендована пациентам с неишемическими заболеваниями сердца, имеющим ФВ ЛЖ менее 35% (основной фактор риска), ХСН ІІ–ІІІ ФК по классификации NYHA, получающим постоянную оптимальную лекарственную терапию, с хорошим функциональным статусом* и имеющим благоприятный прогноз выживания в течение года и более (А).
4. У пациентов с ЖТ (основной фактор риска) по механизму re-entry по ножкам пучка Гиса (bundle branch reentry), верифицированной в ходе эндоЭФИ показано проведение катетерной абляции ПНПГ (С).
5. Сопутствующая терапия амиодароном, соталолом в виде монотерапии или в сочетании с β-адреноблокаторами с целью уменьшения симптомов ЖТ (как устойчивой, так и неустойчивой) рекомендована пациентам с имплантированными ИКД, получающим терапию по поводу ДКМП (С).
6. Амиодарон показан пациентам с целью лечения гемодинамически значимых ЖТ и НЖТ (основные факторы риска ВСС) в случае, если кардиоверсия и/или коррекция причин возникновения аритмии не
смогли устранить или предотвратить ее ранний рецидив (В).
Класс IIa
1. В целях первичной профилактики ВСС ИКД-терапия, комбинированная с бивентрикулярной ЭКС, показана пациентам с ДКМП и ХСН III–IV ФК по NYHA (основной фактор риска), получающим оптимальную лекарственную терапию, у которых длительность комплекса QRS на фоне синусового ритма превышает 120 мс, которые имеют хороший функциональный статус* и благоприятный прогноз выживания в течение года и более (В).
2. ИКД-терапия показана пациентам с рецидивирующей гемодинамически стабильной ЖТ (основной фактор риска), незначительно сниженной ФВ ЛЖ, получающим оптимальное лечение по поводу ДКМП с хорошим функциональным статусом и имеющим благоприятный прогноз выживания в течение года и более (С).
3. Бивентрикулярная ЭКС без функции ИКД целесообразна для предотвращения ВСС у пациентов с ДКМП и ХСН III–IV ФК по классификации NYHA, ФВ ЛЖ менее 35% (основной фактор риска), длительностью комплексов QRS 160 мс (или по меньшей мере 120 мс при наличии других признаков асинхронного сокращения желудочков), получающих постоянную оптимальную лекарственную терапию, с хорошим функциональным статусом и имеющих благоприятный прогноз выживания в течение года и более (В).
Класс IIb
1. Амиодарон и/или бета-блокаторы могут быть назначены пациентам с основными и второстепенными факторами риска ВСС, получающим оптимальное лечение по поводу ХСН, которым невозможно имплантировать ИКД.
2. В целях первичной профилактики ВСС ИКД-терапия может обсуждаться у пациентов с ДКМП, имеющих ФВ ЛЖ от 30 до 35% (основной фактор риска ВСС), ХСН І ФК по классификации NYHA, получающих постоянную оптимальную лекарственную терапию, с хорошим функциональным статусом и имеющих благоприятный прогноз выживания в течение года и более (В).
Класс III
1. Назначение препаратов IC класса для лечения ЖА (основной фактор риска ВСС) не рекомендуется у пациентов с ХСН (А).
2. ИКД-терапия не показана пациентам с рефрактерной ХСН, у которых маловероятно достижение компенсации и благоприятного прогноза (А).
VII.4.Б. Стратификация риска и профилактика ВСС у пациентов c гипертрофической кардиомиопатией
Гипертрофическая кардиомиопатия (ГКМП) – развитие гипертрофии миокарда левого желудочка без артериальной гипертонии или клапанных пороков сердца. Частота встречаемости составляет около 1 случая на 500 человек. Кроме того, в современной классификации выделяют ГКМП, связанную с ожирением, редкие случаи чрезмерной ГЛЖ у спортсменов, ГКМП у детей, матери которых больных сахарным диабетом и ГКМП вследствие амилоидоза. Обычно определяется утолщение стенок ЛЖ более или равное 15 мм (для детей более или равное 2 стандартным отклонениям) при условии отсутствия других причин, которые потенциально могут вызвать ГЛЖ, которое не сопровождается развитием дилатации камер сердца [174].
Существенное значение в диагностике ГКМП имеет наличие очаговой гипертрофии миокарда и изменений пространственной ориентации кардиомиоцитов (хаотичность их расположения) [175]. Предполагается, что эти изменения служат субстратом для развития аритмий.
Генетический анализ
Поскольку ГКМП имеет преимущественно наследственное происхождение, тщательный сбор семейного анамнеза приобретает диагностический смысл, при этом при возможности следует обследовать и родственников больного [174, 182–185].
Рекомендации по генетическому тестированию
Класс I
1. У всех пациентов с ГКМП рекомендуется тщательное изучение семейного анамнеза в не менее 3-х поколениях (А)
2. Генетическое тестирование на ГКМП рекомендуется у пациентов с нетипичной клинической картиной ГКМП (B).
3. Семейный скрининг, включающий ЭКГ, ЭХО-КГ и клиническую оценку через 1–1,5 г. у детей и подростков, и примерно каждые 5 лет и у взрослых, а также проведение генетического тестирования рекомендуются у родственников больного ГКМП первой степени родства (B)
Стратификация риска ВСС
Относительно низкая частота заболевания создает трудности в стратификации риска ВСС у больных этой категории, поскольку существует опасность того, что ложноположительные результаты для любого фактора стратификации могут возобладать над истинно положительными результатами. В одном из исследований 23 из 480 больных умерли внезапно, хотя клинические наблюдения предполагали, что они проживут еще 6,5 года. Риск ВСС был непосредственно связан с толщиной стенки ЛЖ. Установлено, что в течение 20 лет пациенты с ГКМП с толщиной стенки ЛЖ менее 20 мм практически не умирали, тогда как у пациентов с толщиной стенки ЛЖ 30 мм или более смертность составила почти 40% за этот же период времени. В ряде исследований отмечен как основной фактор риска ВСС такой признак как соотношение толщины МЖП и задней стенки ЛЖ равное 1:1. [174, 176, 177].
Американская коллегия кардиологов и Европейское кардиологическое общество упорядочили по категориям известные факторы риска ВСС как «основные» и «возможные» для отдельных групп больных ГКМП (таблица VII.4.1). Рекомендуется проводить клиническую оценку пациентов с ГКМП для стратификации риска ВСС каждые 12–24 месяца [174, 176, 177, 178–181].
Роль генетического тестирования у пациентов с ГКМП в отношении стратификации риска ВСС в настоящее время остается до конца не изученной (класс показаний IIb, B). Генетическое тестирование на ГКМП рекомендуется у пациентов с нетипичной клинической картиной ГКМП (I, B). Семейный скрининг должен включать проведение регистрации ЭКГ, эхокардиографию и клиническую оценку через определенные промежутки времени (от 12 до 18 месяцев у детей и подростков и примерно каждые 5 лет и у взрослых). Проведение генетического тестирования рекомендовано у родственников больного ГКМП первой степени родства (I, B) [174, 182–185].
Проведение ХМ-ЭКГ рекомендовано при начальной оценке риска развития ВСС у пациентов с ГКМП (I, B), в последующем – каждые 1–2 года при отсутствии указаний в анамнезе на эпизоды ЖТ (IIа, С)
[174, 179, 186].
Стресс-тест с контролем АД и ЭКГ является желательным для стратификации риска ВСС у пациентов с ГКМП (IIa, B). Патологический ответ АД во время теста (определяется либо как неспособность к увеличению АД более чем на 20 мм рт. ст. или падение АД более чем на 20 мм рт. ст. во время теста) предлагается рассматривать как основной фактор, обуславливающий риск развития ВСС [187–189].
Некоторые авторы предлагают рассматривать МРТ сердца с гадолинием как дополнительную методику, помогающую клиницисту в стратификации риска и принятии тактического решения (IIa, С) у пациентов с установленным диагнозом ГКМП при невозможности стратификации риска ВСС на основании общеизвестных факторов [174, 190].
Таблица VII.4.1
Факторы риска ВСС у больных ГКМП
| «Большие» факторы риска развития ВСС | Развитие ВСС в озможно у отдельных пациентов |
|---|---|
| — Сердечный арест — Спонтанная устойчивая желудочковая тахикардия — Семейный анамнез случаев ВСС — Необъяснимые синкопе — Утолщение стенок левого желудочка ≥ 30 мм — Неустойчивая спонтанная желудочковая тахикардия |
— Фибрилляция предсердий — Ишемия миокарда — Наличие высоко рисковых мутаций генов — Интенсивная (соревновательная) физическая нагрузк |
Рекомендации по профилактике ВСС
Класс I
1. ИКД-терапию следует проводить пациентам с ГКМП и такими основными факторами риска ВСС как устойчивая ЖТ или ФЖ, которые получают оптимальную лекарственную терапию основного заболевания и имеют хороший функциональный статусом и благоприятный прогноз выживания в течение года и более (B).
2. Бета-блокаторы рекомендуются для лечения симптоматичных
взрослых пациентов с обструктивной или необструктивной формой
ГКМП, но их следует использовать с осторожностью у пациентов с
синусовой брадикардией или нарушениями АВ-проводимости (B).
3. Септальная миотомия для лечения пациентов с тяжелыми рефрактерными к консервативной терапии симптомами* и обструкцией ВТЛЖ
(С)**.
Класс IIа
1. ИКД-терапия показана для первичной и вторичной профилактики ВСС у пациентов с ГКМП, имеющих как минимум один из основных факторов риска (см. табл. VII.4.1) – сердечный арест, спонтанная устойчивая ЖТ, семейный анамнез ВСС, синкопальные состояния неясной этиологии, толщина стенки ЛЖ более 30 мм, патологические изменения АД при нагрузочной пробе, спонтанная неустойчивая ЖТ, которые получают постоянную лекарственную терапию, с хорошим функциональным статусом и имеют благоприятный прогноз выживания в течение года и более (С).
2. Спиртовая эмболизация показана взрослым больным ГКМП с обструкцией ВТЛЖ (основной фактор риска у данной категории пациентов) при условии рефрактерности симптомов к медикаментозной
терапии и наличии противопоказаний к проведению миотомии /миоэктомии, обусловленных серьезными сопутствующими заболеваниями и/или преклонным возрастом (B).
3. Амиодарон может быть препаратом выбора для лечения пациентов с ГКМП со стойкой ЖТ и/ или ФЖ в анамнезе (основные факторы риска), при невозможности имплантации ИКД (С).
4. Проведение расширенной миоэктомии может обсуждаться у пациентов с обструктивной формой ГКМП и резистентностью к медикаментозной терапии (С).
Класс IIb
1. Применение амиодарона может быть оправдано для проведения первичной профилактики ВСС у пациентов с ГКМП, имеющих один
* – Клинические симптомы включают стенокардию III – IV ФК, обмороки, предобморочные состояния, головокружение, гипотензию, которые сохраняются, несмотря на оптимальную медикаментозную терапию. Градиент давления в ВТЛЖ в состоянии покоя или при выполнении физиологической нагрузки должен превышать 50 мм рт. ст.
** – Операция должна выполняться только опытными операторами (выполнившими не менее 20 процедур или работающими в центре, где выполняется не менее 50 процедур в год).
или более основных факторов риска ВСС, если невозможно выполнить имплантацию ИКД (С).
2. Постоянная двухкамерная ЭКС с укороченной АВ-задержкой может быть показана больным обструктивной формой ГКМП с выраженными симптомами заболевания рефрактерными к лекарственной терапии и не являющихся кандидатами для процедуры септальной редукции при условии снижения систолического градиента ВТЛЖ на 25% и более при пробной двухкамерной ЭКС с оптимальным значением АВ-задержки (B).
3. Опыт использования соталола ограничен у пациентов с ГКМП, но его использование возможно в отдельных клинических ситуациях, особенно у пациентов с ИКД (С).
Класс III
1. Имплантация ИКД не рекомендуется больным ГКМП с отсутствием основных факторов риска ВСС (С).
2. Имплантация ИКД не рекомендуется больным ГКМП с положительным генотипом (возможный фактор риска) и отсутствием клинической симптоматики (С).
3. Спиртовая эмболизация не должна выполняться у больных с выраженной гипертрофией МЖП (более 30 мм) в связи с неопределенной эффективностью процедуры у данной категории пациентов (С).
4. Спиртовая эмболизация не должна выполнятся у бессимптомных пациентов, у больных с медикаментозно контроллируемыми симптомами, у пациентов с предполагаемыми оперативными вмешательствами
на сердце, когда миоэктомия может быть выполнена, как часть или этап операции (С).
5. Назначение нитратов, нифедипина и высоких доз диуретиков является потенциально опасным у пациентов с обструктивной ГКМП (С).
6. Назначение сердечных гликозидов при отсутствии ФП является
потенциально опасным у больных ГКМП (В).
VII.4.1.В. Стратификация риска и профилактика ВСС у пациентов c АДПЖ
Аритмогенная кардиомиопатия/дисплазия правого желудочка (АДПЖ) – заболевание, характеризующееся прогрессирующим замещением миокарда правого желудочка жировой и фиброзной тканью, сопровождающееся снижением функции правого желудочка преимущественно проявляющаяся клинически желудочковыми нарушениями ритма. Доказано наследственное происхождение АДПЖ, кроме того, считается, что в развитии заболевания могут иметь значение процессы воспаления. [191–193].
По данным эпидемиологических исследований встречаемость АДПЖ в общей популяции составляет от 1:1000 до 1:5000, соотношение мужчин и женщин среди больных с АДПЖ составляет 3:1 [194–197]. АДПЖ – одна из наиболее частых причин ВСС у лиц моложе 35 лет в развитых странах мира [196, 197]. Российские эпидемиологические данные соответствуют мировым: АДПЖ является второй по значимости причиной ВСС у лиц ≤ 35 лет (14,1%) после алкогольной КМП с распределением умерших больных по полу в соотношении мужчин и женщин 3:1 [197].
Семейные формы АДПЖ составляют как минимум 50% от всех случаев с преимущественно аутосомно-доминантным типом наследования (идентифицировано 12 генов, кодирующих различные компоненты миокардиальных десмосом) и вариабельной пенетрантностью [4, 191, 359].
Диагноз АДПЖ устанавливается на основании совокупности «больших» и «малых» диагностических критериев согласно Международным критериям диагностики АДПЖ 1994 года в модификации 2010 года
[191, 198].
Генетический анализ
Данные генетического тестирования у больных с АДПЖ в настоящее время очень ограничены, чтоне позволяет делать выводы о его роли в стратификации риска ВСС и определении лечебной стратегии у больных с АДПЖ. Ниже перечислены условия, при которых целесообразно проводить генетическое тестирование у данной категории пациентов [191].
Рекомендации по генетическому тестированию
Класс IIb
1. Комплексное тестирование генов, кодирующие белки миокардиальных десмосом (DSC2, DSG2, DSP, JUP, PKP2, TMEM43) целесообразно у пациентов с диагнозом АДПЖ, установленным в соответствии с Международными Критериями в модификации 2010 года (C).
2. Генетическое тестирование может быть рекомендовано пациентам с высокой вероятностью наличия АДПЖ согласно Международным Критериям в модификации 2010 года, т.е. при наличии 1-го большого или 2-х малых критериев АДПЖ (C).
3. Поиск специфичекой мутации показан членам семьи и ближайшим родственникам больных с доказанной генетически детерменированной формой АДПЖ в случае определения у больного дефектного гена, ответственного за развитие заболевания (C).
Класс III
1. Генетическое тестирование не показано пациентам при наличии только 1 малого критерия АДПЖ согласно Международным Критериям в модификации 2010 года (C).
Здоровые носители дефектных генов не требуют специфического профилактического лечения. Эта категория лиц будет нуждаться в регулярном скрининговом обследовании с целью ранней диагностики бессимптомных ЖА, включающем в себя тщательный сбор анамнеза и генеалогический анализ при генетически детерминированных формах АДПЖ, регистрацию ЭКГ в 12 отведениях, проведение ХМ-ЭКГ, анализа поздних потенциалов желудочков, пробы с физической нагрузкой и трансторакальной ЭХО-КГ [191, 200].
Стратификация риска
Патогномоничными клиническими проявлениями АДПЖ являются ЖА, варьирующие от одиночной ЖЭ до устойчивой ЖТ и ФЖ, приводящей к ВСС. Последняя, в свою очередь, может быть первым и единственным клиническим проявлением этого заболевания [191]. Наиболее часто встречающимися симптомами АДПЖ являются тахикардия и/ или ощущения сердцебиения, синкопе и ВСС, которые наблюдаются в 27, 26 и 23% случаев соответственно [191–194]. ФЖ является механизмом мгновенной ВСС у молодых больных с АДПЖ, которые до этого являлись асимптомными. У больных с длительным анамнезом АДПЖ более вероятна возможность регистрации устойчивых мономорфных гемодинамически стабильных ЖТ [193]. Прогрессирование заболевания может проявляться клиническими симптомами бивентрикулярной сердечной недостаточности.
ЖА с морфологией комплексов QRS по типу БЛНПГ являются отличительной особенностью АДПЖ и указывает на правожелудочковый характер аритмий. У пациентов с диффузными формами АДПЖ может наблюдаться несколько морфологических классов ЖА [191–194].
ВСС является основной причиной смерти при данной патологии и 0,08–9,0% больных с АДПЖ в год умирают внезапно [191, 194, 199–201].
Относительно часто ВСС у больных с АДПЖ развивается при физической нагрузке, и частота встречаемости АДПЖ среди внезапно умерших спортсменов достигает 25% [191].
Ретроспективный клинический и патоморфологический анализ свидетельствует, что кроме основных факторов риска ВСС (указание в анамнезе на эпизод сердечного ареста, наличие синкопальных состояний, эпизоды устойчивой ЖТ) клиническое значение в данной категории больных могут иметь: молодой возраст, отягощённый семейный анамнез, занятия профессиональным спортом, сократительная дисфункция правого желудочка, вовлечение в патологический процесс левого желудочка, дисперсия длительности комплекса QRS>40 мс, нарушения реполяризации в грудных отведениях ЭКГ [199, 200].
Однако, прогностическая значимость каждого из вышеперечисленных факторов и их комбинация чётко не определена. В 2011 году на основании результатов 10-летнего наблюдения за группой, состоящей из 96 больных АДПЖ, было показано, что присоединение дисфункции ЛЖ к предсуществующей дисфункции ПЖ являлось наиболее неблагоприятным прогностическим фактором в отношении их выживаемости [191].
Рекомендации по профилактике ВСС
Класс I
1. Имплантация ИКД показана для профилактики ВСС пациентам с установленным диагнозом АДПЖ, при наличии доказанной устойчивой ЖТ или эпизода ФЖ (основные факторы риска), имеющим хороший функциональный статус, при условии ожидаемой продолжительности жизни более 1 года (В).
Класс IIa
1. Имплантация ИКД может быть эффективна для профилактики ВСС у пациентов с тяжёлыми формами АДПЖ, имеющим такие факторы риска как вовлечение в патологический процесс ЛЖ, семейный анамнез ВСС у одного и более членов семьи (или наличие у членов семьи эпизодов синкопе неясной этиологии, в случаях, когда ЖT или ФЖ не были исключены как причина синкопе), имеющих хороший функциональный статус, при условии ожидаемой продолжительности жизни более 1 года (С).
2. Амиодарон или соталол может быть эффективен для лечения устойчивой ЖТ или ФЖ (основные факторы риска) у пациентов с АДПЖ при невозможности или нецелесообразности имплантации ИКД (С).
3. Радиочастотная катетерная абляция целесообразна в качестве дополнительного метода лечения пациентов с АДПЖ, у которых имеются рецидивы устойчивой ЖТ, несмотря на проводимую ААТ (C).
Класс IIb
1. Эндокардиальное ЭФИ может проводиться у пациентов с установленным диагнозом АДПЖ для стратификации риска ВСС, а также для оценки эффективности ААТ (С).
VII.5. ВСС при синдроме WPW
Cиндром WPW – это сочетание ЭКГ-феномена, иллюстрирующего предвозбуждение желудочков сердца по дополнительному (аномальному) атриовентрикулярному соединению (ДАВС) и пароксизмальной атриовентрикулярной реципрокной (ре-ентри) тахикардии (АВРТ), возникающей в результате реализации механизма повторного входа электрического возбуждения структурными составляющими омпонентами, которого являются врожденное добавочное атриовентрикулярное соединение, нормальное атриовентрикулярное соединение (АВС), миокард предсердий и желудочков [202–204].
О феномене WPW говорят в том случае, если у пациента на фоне синусового ритма на поверхностной ЭКГ имеются признаки антероградного (от предсердия к желудочкам) проведения по ДАВС (предвозбуждение желудочков), но в анамнезе нет указаний на клинические проявления или факт верификации АВРТ на ЭКГ [202, 203].
Термин синдром WPW относится и к пациентам, у которых предвозбуждение желудочков сочетается с иной симптоматической тахикардией, отличной от АВРТ, например – фибрилляцией или трепетанием предсердий [202–204].
По данным различных авторов распространенность синдрома WPW в общей популяции составляет 0,1–0,3% [202–205].
Среди пациентов с синдромом WPW риск ВСС в течение 3–10 лет составляет от 0,15 до 0,39%, что выше общепопуляционного риска ВСС [202–204, 211, 212]. Нередко сердечный арест является первым клиническим симптомом синдрома WPW.
К основным факторам риска ВСС у пациентов с синдромом/ феноменом WPW (в порядке уменьшения их значимости) относятся: эпизод фибрилляции предсердий с величиной интервала RR 260 мс и менее на фоне антероградного проведения по ДАВС, наличие синкопальных состояний в анамнезе, структурная патология сердца, семейный анамнез синдрома WPW и ВСС, величина антероградного рефрактерного периода ДАВС меньше 270 мс [204, 207, 208, 211–213].
Стратификация риска
Алгоритм стратификации риска ВСС представлен в таблице VII.5.1.
Таблица VII.5.1
Стратификация риска ВСС у пациентов с синдромом WPW
| 1. Есть ли признаки предвозбуждения на ЭКГ | |
| Да | Нет |
| См. пункт 2 | |
| 2. Есть ли симптоматическая тахикардия и/или синкопальные состояния в анамнезе | |
| Да | Нет |
| эндоЭФИ и РЧА ДАВС | См. пункт 2 |
| 2. Есть ли семейный анамнез синдрома WPW и ВСС | |
| Да | Нет |
| ЭндоЭФИ и РЧА ДАВС | См. пункт 3 |
| 3. Есть ли структурная патология сердца | |
| Да | Нет |
| ЭндоЭФИ и РЧА ДАВС | См. пункт 4 |
| 4. Предвозбуждение желудочков асимптомно | |
| См. рекомендации по профилактике ВСС | |
Он основан на выявлении основных факторов риска возникновения ВСС у пациентов с синдромом WPW [204, 208, 210]. Последовательная реализация данного алгоритма позволит определить перечень мероприятий, необходимых для проведения первичной/вторичной профилактики ВСС в каждом конкретном клиническом случае.
При стратификации риска ВСС у данной категории пациентов, основной задачей является выявление клинических признаков (основных факторов риска и их сочетания), ассоциированных с высоким
риском развития ВСС. В конечном итоге, это будет определять последовательность мероприятий по профилактике ВСС.
Рекомендации по профилактике ВСС
Класс I
1. Больным с признаками предвозбуждения желудочков на ЭКГ, перенесшим сердечный арест, необъяснимые обмороки (основные факторы риска) или симптоматичную тахикардию показано проведение РЧА
ДАВС (В).
2. Пациентам с фибрилляцией предсердий (или другой предсердной тахикардией), сопровождающейся высокочастотной активацией миокарда желудочков (величиной интервала RR 260 мс и менее на фоне
антероградного проведения по ДАВС – основной фактор риска ВСС), показано проведение РЧА (В).
3. У пациентов с синдромом WPW, имеющим основные факторы риска и которые предпочитают медикаментозную терапию проведению РЧА, средствами выбора являются ААП I класса или амиодарон (С)
4. Представителям рисковых профессий (пилоты самолетов, водители общественного транспорта, спортсмены) у которых диагностируется синдром/феномен WPW вне зависимости от наличия симптомов и величины антероградного ЭРП ДАВС показано проведение РЧА ДАВС даже при отсутствии основных факторов риска ВСС (В).
5. Пациенты с феноменом WPW, у которых антероградный ЭРП ДАВС менее 270 мс показано проведение РЧА ДАВС (основной фактор риска) (В).
Класс IIа
1. Пациентам с признаками предвозбуждения желудочков на ЭКГ, отсутствием основных факторов риска (указания в анамнезе на симптоматичную тахикардию, синкопе, семейный анамнез ВСС, наличие структурной патологии сердца, величина антероградного ЭРП ДАВС более 270 мс) показано динамическое наблюдение кардиологом (С).
2. Пациентам с признаками предвозбуждения желудочков на ЭКГ, отсутствием в анамнезе указаний на симптоматичную тахикардию, синкопе, семейный анамнез ВСС, наличие структурной патологии сердца, у которых величина антероградного ЭРП ДАВС более 270 мс не показано назначение ААП (С).
Класс IIb
1. У пациентов с феноменом WPW, у которых величина антероградного ЭРП ДАВС превышает 270 мс, возможно проведения РЧА (С).
Класс III
1. Пациентам с синдромом/феноменом WPW противопоказано назначение дигоксина, бета-блокаторов, верапамила и АТФ (С).
VII.6. ВСС при пороках клапанов сердца
VII.6.A. ВСС при врожденных пороках сердца
Стратификация риска
Врожденные пороки сердца (ВПС) представляют собой многообразный спектр анатомических и физиологических дефектов с различными вариантами клинического течения заболевания. Риск развития аритмий на пред- и послеоперационном этапах хирургической коррекции порока, предполагает возможность ВСС. Особенность состоит в том, что более 75% младенческих и детских смертей от ВПС происходит в стационаре,большинство из которых – в ходе операций. Остальные смерти происходят вне стационара или в реанимационных отделениях в результате других врожденных аномалий развития или сепсиса. У больных, оперированных по поводу ВПС в возрасте старше 20 лет, отмечается прогрессирующее увеличение частоты ВСС и сердечно-сосудистой смертности.
С высоким риском ВСС в отдаленном периоде ассоциируются 5 типов ВПС: тетрада Фалло, D- и L-транспозиция магистраль72 Vii . Стратификация риска и профилактика всс Vii . Стратификация риска и профилактика всс 73 ных артерий, стеноз аорты и функционально единственный желудочек. Наибольшее количество данных о частоте развития ВСС при ВПС приходятся на пациентов с тетрадой Фалло. В обязательном порядке оперированным больным с эпизодами ВСС в анамнезе должны выполняться как инвазивное исследование гемодинамики, так и эндоЭФИ. Положительные результаты эндоЭФИ, внезависимости от клинического статуса пациента, позволяют выявить больных с высоким риском ВСС в отдаленном периоде после хирургической коррекции порока.
Наиболее распространенная врожденная аномалия развития коронарных артерий, связанная с высоким риском ВСС в молодом возрасте, – это отхождение левой коронарной артерии из правого синуса Вальсальва. Предполагаемыми механизмами ВСС являются либо острая ангуляция устья коронарной артерии и как следствие ее перегиб, либо компрессия левой коронарной артерии, приводящие к развитию острой ишемии миокарда с последующим развитием ЖТ или ФЖ. Диагноз устанавливается в ходе КАГ и служит показанием к проведению хирургической реваскуляризации миокарда.
Существует ограниченное количество экспериментальных данных, на основании которых можно было бы рекомендовать определенную тактику ведения больных с этими заболеваниями. Лечение неотложных состояний, развившихся в рамках основного заболевания, которое относится к этому разделу, осуществляется без каких-либо специфических особенностей.
Рекомендации по профилактике ВСС
Класс I
1. Имплантация ИКД проводится пациентам с врожденным пороком сердца (ВПС), перенесшим сердечный арест (основной фактор риска ВСС), если причина заболевания установлена в ходе обследования и были исключены иные обратимые причины. Имплантация ИКД проводится пациентам с хорошим функциональным статусом, получающим длительную оптимальную лекарственную терапию и имеющим благоприятный прогноз выживания в течение года и более (В).
2. Больным с ВПС и спонтанной устойчивой ЖТ (основной фактор риска ВСС) показано проведение инвазивного исследования параметров внутрисердечной гемодинамики и эндоЭФИ. Рекомендуемые методы терапии – катетерная абляция или хирургическое лечение ЖТ.
Если указанные методы неэффективны, то рекомендуется имплантация ИКД (С).
Класс IIа
1. Инвазивную оценку параметров внутрисердечной гемодинамики и эндоЭФИ целесообразно проводить пациентам с ВПС, имеющим основные факторы риска ВСС – указания в анамнезе на необъяснимые эпизоды синкопе и нарушение сократительной функции желудочков.
2. В отсутствие определенной и потенциально корригируемой причины сердечного ареста (основной фактор риска) имплантация ИКД целесообразна пациентам с хорошим функциональным статусом, получающим длительную оптимальную лекарственную терапию и имеющих благоприятный прогноз для выживания в течение года и более (В).
Класс IIb
1. Проведение эндоЭФИ может обсуждаться у пациентов с ВПС и парными желудочковыми экстрасистолами (ЖЭ) или НЖТ для определения риска возникновения устойчивой ЖТ (С).
Класс III
1. Назначение профилактической ААТ не показано у больных с бессимптомным ВПС и единичными ЖЭ (С).
VII.6.Б. ВСС при приобретенных пороках сердца
Стратификация риска
В настоящее время отсутствуют данные, свидетельствующие о том, что пластика или протезирование митрального клапана уменьшают количество ЖА у пациентов с клапанными пороками сердца. Поэтому оценка клинического состояния этой категории пациентов и их лечение проводятся на основании существующих рекомендаций для каждого из заболеваний.
Рекомендации по профилактике ВСС
Класс I
1. Клиническая оценка состояния больных с клапанными пороками сердца и ЖА, а также выбор тактики их лечения должен осуществляться на основании существующих в настоящее время рекомендаций по диагностике и лечению пороков сердца и выявлении основных и второстепенных факторов риска ВСС (С).
Класс IIb
1. Позитивное значение пластики или протезирования митрального клапана у пациентов с пролапсом митрального клапана, тяжелой митральной регургитацией, сочетающейся с гемодинамически значимыми ЖА (основной фактор риска) в отношении профилактики ВСС не является доказанными (С).
VII.7. ВСС при метаболических и воспалительных заболеваниях
VII.7.A. Стратификация риска и профилактика ВСС у пациентов с миокардитом и инфекционным эндокардитом
Миокардит
Миокардит – поражение сердечной мышцы преимущественно воспалительного характера, обусловленное непосредственным или опосредованным через иммунные механизмы воздействием инфекции, паразитарной или протозойной инвазии, химических или физических факторов, а также поражения, возникающие при аллергических и аутоиммунных заболеваниях [214].
Наиболее частым этиологическим фактором, обуславливающим развитие миокардита более чем в 60% случаев, является вирусная инфекция [215]. В европейской популяции самым частым вирусным геномом, определяющимся в биоптатах миокарда, является парвовирус B-19 и вирус герпеса человека – 6 [216]. Из бактериальных агентов наибольшее значение в последние годы приобретают внутриклеточные возбудители (род Chlamidia) [218]. Среди других причин выделяют прямое и опосредованное воздействие токсических веществ, в том числе лекарств, аллергические и аутоиммунные реакции у лиц с системными заболеваниями (коллагенозы, опухоли, саркоидоз, неспецифический язвенный колит) [214, 217, 219].
Встречаемость миокардита в различных странах Европы различается в разы и колеблется от 0,12% до 12% [215, 216]. В кардиологических стационарах диагноз миокардита выставляется менее чем в % случаев, в то же время по данным аутопсии его признаки выявляются в 3–9% [218].
Результаты секции внезапно умерших людей обнаруживают морфологические маркеры миокардита в 8,6% случаев [219], а у лиц моложе 40 лет – в 12% случаев [220]. По некоторым данным, миокардит является ведущей причиной внезапной смерти у детей [8].
Непосредственным механизмом ВСС у больных миокардитом являются стойкие нарушения ритма и/или проводимости, которые по данным эпидемиологического исследования ESETCID, проведенного в Европе, регистрируются в 18% случаев [221]. При этом прослеживается связь между частотой и тяжестью развития нарушений ритма и морфологическим вариантом миокардита, в частности наибольшая выраженность аритмического синдрома характерна для гигантоклеточного миокардита. По данным другого исследования [222, 223], около 5% случаев миокардита дебютируют развитием желудочковой тахикардии.
Вместе с тем, прогностическая роль различных аритмий, как и других клинико-инструментальных данных, в частности низкой ФВ, в манифестном периоде миокардита до настоящего времени не установлена.
Во многих случаях на фоне адекватной терапии наступает полное исчезновение подобных симптомов [218].
В связи с этим рекомендации по профилактике ВСС у больных миокардитом имеют крайне ограниченный характер, в основном относятся к острому периоду заболевания. Для медикаментозной терапии желудочковых тахиаритмий эффективно назначение амиодарона [224].
Установка временного ЭКС в острой фазе миокардита показана при возникновении гемодинамически значимых брадиаритмий, тогда как вопрос об имплантации ИКД в этот период не рассматривается. Вместе с тем, в более поздние сроки, когда на фоне адекватной ААТ сохраняются устойчивые гемодинамически значимые желудочковые нарушения ритма сердца, а прогноз для жизни пациента благоприятен в течение как минимум календарного года, имплантация ИКД может быть рекомендована.
Инфекционный эндокардит
Инфекционный эндокардит (ИЭ) – воспалительное поражение клапанных структур, пристеночного эндокарда, эндотелия в зоне врождённого порока магистральных сосудов, обусловленное прямым внедрением возбудителя и протекающее чаще всего по типу сепсиса остро или подостро с циркуляцией возбудителя в крови, тромбоэмболиями, иммунопатологическими изменениями и осложнениями [225].
Основными возбудителями ИЭ в последние десятилетия являются стафилококк, стрептококк и энтерококк, которые выделяются у подавляющего большинства больных с положительной гемокультурой [226, 227]. Прослеживается связь между этиологическим фактором и вариантом течения заболевания. Так, при подостром течении ИЭ основным возбудителем являются различные виды Streptococcus, в то время как острое течение ИЭ наиболее часто ассоциировано с инфекцией Staphylococcus [228].
Особенностью эпидемиологии ИЭ последних лет является появление особых форм: ИЭ у наркоманов с преимущественным поражением трёхстворчатого клапана, ИЭ протеза клапана, ИЭ у пациентов с имплантированным электрокардиостимулятором и больных, находящихся на программном гемодиализе, ИЭ у реципиентов трансплантированного органа [229, 230].
Одной из важнейших проблем ИЭ в настоящее время следует признать растущую резистентность возбудителей к наиболее часто применяемым антибиотикам, что во многом обуславливает высокие показатели смертности при данном заболевании, достигающие даже в госпитальных условиях 10–26% [231–233]. Большинство смертей, наступающих внезапно, происходят по причине острой сердечной недостаточности вследствие деструкции клапана либо на фоне молниеносного септического шока, как правило, ассоциированного с абсцедированием клапанного кольца, однако по своему механизму подобные случаи не могут быть отнесены к ВСС [234]. Вместе с тем, формирование абсцесса в области межжелудочковой перегородки (МЖП) или распространение гнойного процесса с кольца аортального клапана на МЖП может привести к разрушению проводящей системы сердца и формированию полной АВ-блокады и развитию ВСС [234]. В этой связи, развитие АВ-блокады у пациента с ИЭ всегда должно настораживать на наличие такого грозного осложнения, как абсцесс.
Лечение больных ИЭ должно быть длительным, комплексным и многокомпонентным. Во всех случаях должна проводиться антимикробная терапия с учетом этиологического фактора, в большинстве случаев
с применением комбинации антибактериальных средств [231–234].
Основными направлениями лечения, помимо антибактериальной терапии, являются также хирургическое лечение и заместительная иммунная терапия.
Рекомендации по профилактике ВСС
Класс I
1. Проведение этиотропной, патогенетической и симптоматической терапии в острой фазе миокардита (С).
2. Хирургическая коррекция острой недостаточности аортального клапана, ассоциированной с ЖТ, при отсутствии противопоказаний (С).
3. Хирургическое лечение острого эндокардита, осложненного абсцессом аорты или клапанного кольца, ассоциированных с
АВ-блокадой, при отсутствии противопоказаний (С).
Класс ІІа
1. Имплантация ИКД может быть эффективной у пациентов с жизнеугрожающими ЖА (основной фактор риска) вне острой фазы миокардита, получающих постоянную оптимальную лекарственную терапию и имеющих благоприятный прогноз для выживания в течение 1 года и более (С).
2. ААТ целесообразна у пациентов с неустойчивой и устойчивой ЖТ в острой фазе миокардита (С).
Класс III
1. Имплантации ИКД не показана в острой фазе миокардита (С).
VII.7.Б. Стратификация риска и профилактика ВСС при метаболическом синдроме, ожирении, диете и анорексии
Метаболический синдром представляет собой совокупность взаимосвязанных факторов риска возникновения и прогрессирования сердечнососудистых заболеваний, обусловленных атеросклерозом [235–238]. Основные его составляющие – абдоминальное ожирение, повышенное АД, атерогенная дислипидемия (повышение уровня триглицеридов и снижение холестерина липопротеидов высокой плотности в крови), резистентность к инсулину (клинически проявляется нарушением толерантности к глюкозе, гипергликемией натощак и сахарным диабетом 2 типа). Для метаболического синдрома характерны протромботические и провоспалительные изменения системы гемостаза, а также многочисленные метаболические и эндокринные нарушения [236, 2373, 239]. Критерии диагностики метаболического синдрома продолжает уточняться и обсуждаться. Так, эксперты Всероссийского научного общества кардиологов настаивают на ведущей роли абдоминального ожирения (избыточного накопления висцерального жира) в патогенезе метаболического синдрома и возражают против уравнивания значимости этого фактора с другими критериями диагностики [240]. Пересматривается также допустимая окружность талии, которая по сегодняшним представлениям должна соответствовать этнической принадлежности и стране проживания индивида [237]. При метаболическом синдроме описан ряд изменений, потенциально способствующих возникновению ВСС – увеличение длительности и дисперсии интервала QT [241–245], изменения вариабельности ритма сердца, свидетельствующие о преобладании симпатических влияний на синусовый ритм и/или снижении вагусной активности [245–255], гипертрофия левого желудочка 78 Vii. Стратификация риска и профилактика всс Vii . Стратификация риска и профилактика всс 79 [256–258]. Кроме того, при выраженных метаболических расстройствах, не исключено введение дополнительных факторов риска ВСС: гипокалиемии [259], гипогликемии, способствующей активации симпатической нервной системы и нарушению реполяризации миокарда с удлинением интервала QT [260, 261], а также синдрома обструктивного сонного апноэ, сопряженного с наличием многих компонентов метаболического синдрома, включая преобладание симпатической активности [262–265].
Выраженные расстройства питания, а также чрезмерные меры по их быстрой коррекции могут способствовать возникновению ВСС. Риск ВСС особенно высок при выраженном ожирении, превышая данный показатель в популяции у лиц, сопоставимых по возрасту, в 40–60 раз [266, 267]. Скорее всего, это связано с возникновением угрожающих жизни желудочковых аритмий, однако у внезапно умерших молодых людей выявлялись также изменения проводящей системы сердца [268]. Среди факторов, предрасполагающих к ВСС, у лиц с ожирением описаны: увеличение длительности и дисперсии интервала QT, формирование характерных структурных изменений сердца (кардиомегалия, дилатация левого желудочка, гипертрофия кардиомоцитов без признаков интерстициального фиброза), а также обструктивное сонное апноэ [270–274]. Риск ВСС при ожирении можно существенно уменьшить при снижении массы тела. Обратимы также проявления кардиопатии и удлинение интервала QT, особенно на ранних стадиях заболевания [275–277]. Низкокалорийная диета, способствующая снижению массы тела, должна быть хорошо сбалансированной. Есть сообщения о возникновении аритмий и случаях ВСС при использовании длительных, не сбалансированных, очень низкокалорийных диет и лечебного голодания (особенно диет с применением жидких протеинов) [278–282].
Смертность у лиц с нервной анорексией колеблется от 5 до 20%, а фактический показатель, вероятно, составляет около 6%. [283].
Считается, что почти 1/3 летальных исходов, в том числе во время возобновления приема пищи, происходит из-за заболеваний сердца, однако точные данные о том, чем обусловлена ВСС, отсутствуют.
Длительное голодание приводит к атрофии сердечной мышцы, синусовой брадикардии, удлинению интервала QT, а также электролитным расстройствам, усугубляющим эти нарушения. Большинство патологических изменений со стороны сердца полностью обратимы после надлежащего возобновления питания [284–286]. Осложнения, связанные с возобновлением питания у длительно голодавших, включают сердечные, неврологические и гематологические расстройства, обусловленные возникновением дисбаланса жидкости и электролитов. Сердечные осложнения возникают, как привило, в первую неделю после начала приема пищи и обычно связаны с выраженным дефицитом питания, гипофосфатемией и использованием только парентерального питания [287–290].
Стратификация риска ВСС
Каждый из основных компонентов метаболического синдрома (ожирение, артериальная гипертензия, нарушение обмена липидов, сахарный диабет), будучи в достаточной степени выраженным, является фактором риска ВСС [291, 292]. В настоящее время не ясно, несет ли объединение этих предрасполагающих факторов в рамках метаболического синдрома дополнительную информацию, позволяющую улучшить стратификацию риска ВСС [292].
Рекомендации по профилактике ВСС
Класс I
1. Особенностей профилактики и лечения угрожающих жизни ЖА (основной фактор риска) и ВСС у больных с метаболическим синдромом, ожирением, анорексией или придерживающихся определенной диеты нет. Мероприятия по предотвращению ВСС должны быть такими же, как и при других заболеваниях. Это подразумевает, что стратификация риска и профилактика ВСС у этой категории пациентов осуществляется на основании выявления основных и второстепенных факторов риска. Профилактика ВСС будет заключаться в имплантации ИКД пациентам с хорошим функциональным статусом и благоприятным прогнозом выживаемости в течение года и более, которые получают длительную оптимальную лекарственную терапию (C).
Класс IIa
1. Программное снижение массы тела при ожирении (модификация второстепенного фактора риска ВСС) и тщательно контролируемое возобновление питания при анорексии может эффективно снизить риск возникновения ЖА и ВСС (C).
Класс III
1. Длительные, несбалансированные, очень низкокалорийные диеты и лечебное голодание не рекомендуются, поскольку они могут быть опасными и приводить к развитию угрожающих жизни ЖА (C).
VII.7.B. Стратификация риска и профилактика ВСС у пациентов с эндокринными нарушениями
Стратификация риска
Нарушения гормональной регуляции могут являться прямой или опосредованной причиной ВСС в результате развития жизнеугрожающих нарушений ритма и проводимости. Эндокринопатии могут оказывать как непосредственное влияние на миокард (например, феохромоцитома, тиреотоксикоз, гипотиреоз), так и быть причиной развития состояний, которые потенциально могут сопровождаться риском развития аритмий (например, электролитные нарушения, связанные с дисфункцией гормонов коры надпочечников). Некоторые эндокринные нарушения сопровождаются развитием условий, способствующих появлению структурной патологии сердца, при которой имеется риск развития ВСС (например, дислипидемия увеличивает риск развития ИБС, а вторичная артериальная гипертензия эндокринного генеза способствует развитию гипертрофия миокарда ЛЖ).
Сахарный диабет
Известно, что в популяции больных, перенесших ИМ, диагноз сахарного диабета увеличивает риск развития ВСС [293–295]. Предполагаемыми механизмами, лежащим в основе развития ВСС у
этой категории пациентов, являются автономная нейропатия при которой наблюдается увеличение интервала QT; а также тяжелая ассимптомная ишемия миокарда, способствующая развитию ЖТ и ФЖ.
Нормализация уровня гликемии или уровня гликированного гемоглобина НвА1с уменьшает риск сердечно-сосудистых заболеваний.
Однако, данных о том, что при этом происходит уменьшение количества внезапных смертей, нет. Напротив, в ряде исследований было продемонстрировано, что интенсивный контроль гликемии, особенно при наличии симптомов автономной нейропатии, повышает риск развития ВСС, что может быть связано с увеличением риска развития гипогликемических состояний, которые сопровождаются удлинением интервала QT и уменьшением уровня калия сыворотки крови.
Акромегалия
Основной причиной смерти у больных с акромегалией является поражение сердечно-сосудистой системы [296]. При длительно существующей и активной (с сохраненной гиперсекрецией гормона роста) акромегалии развивается. так называемая акромегалическая кардиопатия, которая характеризуется концентрической гипертрофией миокарда, диастолической, а позже и систолической дисфункцией ЛЖ с развитием тяжелой, рефрактерной к медикаментозной терапии, сердечной недостаточности Хроническая гиперсекреция гормона роста (ГР) и инсулиноподобного фактора роста-1 (ИПФР-1) также сопровождается развитием инсулинорезистентности, СД 2 типа, дислипидемии и способствует появлению артериальной гипертензии и ГЛЖ. У больных акромегалической кардиопатией чаще, чем в общей популяции, обнаруживают различные нарушения ритма и проводимости сердца [297]. Частота ЖНР коррелирует с длительностью анамнеза заболевания, а их гемодинамическая значимость – с выраженностью ГЛЖ, нежели биохимическими признаками активности заболевания. По некоторым данным около 75% больных акромегалией страдают синдромом апноэ/гипопноэ сна [298], в рамках которого нередко встречаются жизнеопасные нарушения ритма сердца. У 56% больных активной акромегалией регистрируются поздние потенциалы желудочков, наличие которых не зависит от возраста, пола больных, длительности заболевания и выраженности гипертрофии левого желудочка [299, 300]. Тем не менее, окончательное суждение о прогностическом значении поздних потенциалов желудочков в отношении риска развития ВСС у больных акромегалией остается не учрежденным. Нормализация (или снижение) ГР и ИПФР-1 приводит к уменьшению частоты ЖЭ.
Рекомендации по профилактике ВСС
Класс I
1. Тактика терапии ЖА, которая является вторичной по отношению к эндокринным нарушениям, должна быть направлена на коррекцию электролитного дисбаланса и лечение основного заболевания (C).
2. Особенностей профилактики и лечения угрожающих жизни ЖА (основной фактор риска) и ВСС у больных с эндокринными заболеваниями нет. Мероприятия должны быть такими же, как при других заболеваниях. Это означает, что стратификация риска и профилактика ВСС у этой категории пациентов осуществляется на основании выявления основных и второстепенных факторов риска. Проведение профилактики ВСС включает в том числе, имплантацию ИКД и ЭКС пациентам, которые получают длительную оптимальную лекарственную терапию, с хорошим функциональным статусом и благоприятным прогнозом выживаемости в течение года и более (C).
VII.7.Г. Стратификация риска и профилактика ВСС у пациентов с терминальной стадией почечной недостаточности
Стратификация риска
Около 40% пациентов с терминальной стадией почечной недостаточности умирают от сердечно-сосудистых заболеваний, в том числе 20% – внезапно [301–302]. Помимо коронарного атеросклероза дополнительными факторами риска развития внезапной сердечной смерти у пациентов хронической болезнью почек могут быть ГЛЖ, уремическая кардиомиопатия, анемия, удлинение интервала QT и увеличение его дисперсии, снижение вариабельности сердечного ритма, а также быстрые изменения объема циркулирующей крови и электролитов, неадекватность диализа, гиперфосфатемия, гиперпаратиреоз и др. [302, 303].
Рекомендации по профилактике ВСС
Класс I
1. Для профилактики ВСС у больных терминальной почечной недостаточностью необходимо выявлять основные (ЖНР, систолическая дисфункция, синкопе, сердечный арест в анамнезе) и модифицировать второстепенные факторы риска (артериальная гипертония, дислипидемия, гипергликемия), а также факторы риска, связанные с хронической болезнью почек и диализом (лечение нефрогенной анемии и гиперпаратиреоза, устранение дефицита витамина D, адекватный диализ, избегать применения диализной жидкости с низким содержанием калия и кальция) (С).
Класс IIа
1. В целях вторичной профилактики ВСС у пациентов, находящихся на на программном гемодиализе или постоянном амбулаторном перитонеальном диализе показано назначение блокаторов ангиотензиновых рецепторов (С) и ААП III класса (С).
2. В целях первичной профилактики ВСС у пациентов, находящихся на программном гемодиализе или постоянном амбулаторном перитонеальном диализе показано назначение иАПФ (В).
3. У пациентов с хронической болезнью почек, и основными факторами риска ВСС (угрожающими жизни аритмиями и систолической дисфункцией ЛЖ) ИКД-терапия имеет преимущество над медикаментозной терапией, однако у диализных пациентов благоприятный эффект этого вида лечения на выживаемость не доказан. Решение об имплантации ИКД следует принимать индивидуально с учетом состояния пациента и ожидаемой продолжительности жизни (С). Нахождение на программном гемодиализе или постоянном амбулаторном перитонеальном диализе, тем не менее, не должно рассматриваться как решающий аргумент в пользу отказа от имплантации ИКД.
Класс IIb
1. В целях первичной профилактики ВСС у пациентов с ИБС, находящихся на программном гемодиализе или постоянном амбулаторном перитонеальном диализе может обсуждаться назначение селективных
бета-блокаторов (С).
2. В целях первичной профилактики ВСС у пациентов при отсутствии признаков поражения коронарных артерий, находящихся на программном гемодиализе или постоянном амбулаторном перитонеальном диализе может обсуждаться назначение никорандила (С).
VII.8. ВСС при болезнях перикарда
Рекомендации по профилактике ВСС
Класс I
1. Стратификация риска и профилактика ВСС у пациентов с болезнями перикарда осуществляется на основании выявления основных и второстепенных факторов риска. Проведение профилактики подразумевает, в том числе, имплантацию ИКД пациентам с основными факторами риска ВСС, которые получают длительную оптимальную лекарственную терапию, с хорошим функциональным статусом* и благоприятным прогнозом выживаемости в течение года и более (C)
VII.9. ВСС у пациентов с хронической обструктивной болезнью легких
Хроническая обструктивная болезнь легких (ХОБЛ) – одно из наиболее распространенных заболеваний взрослого населения во всем мире, которым страдает от 7 до 18,2% лиц, старше 40 лет [304–306]. В последние 25 лет наблюдается неуклонный рост смертности от ХОБЛ и по прогнозам экспертов к 2020 году данная патология займет 3-е место среди всех причин смерти [307].
ХОБЛ это хроническое заболевание, характеризующееся персистирующим ограничением воздушного потока в дыхательных путях, которое обычно носит прогрессирующий характер и связано с воспалительным ответом на длительное вдыхание частиц или газов. Тяжесть течения ХОБЛ во многом определяется частотой обострений и сопутствующей патологией [308]. Наиболее частой сопутствующей проблемой у больных ХОБЛ являются сердечно-сосудистые заболевания, в большинстве случаев ИБС, сердечная недостаточность, фибрилляции предсердий и артериальная гипертония. По данным крупного исследования, включавшего более 1800 пациентов, у больных ХОБЛ существует повышенный, в 3,36 раза, риск смерти от сердечно-сосудистых событий в целом и в 5,65 раза от ишемической болезни сердца [309].
Имеется прямая зависимость риска смерти от величины объема форсированного выдоха за 1-ю секунду (ОФВ1) – главного количественного критерия бронхиальной обструкции [310].
При этом, пациенты, находящиеся на более легких стадиях ХОБЛ, имеют гораздо больше рисков умереть не от дыхательной недостаточности, а от сердечно-сосудистой патологии [311].
Эпидемиологические данные по сочетанию ХОБЛ с сердечной патологией представляют достаточно широкий диапазон цифр. Например, среди 14703 пациентов в исследовании VALIANT, переносящих острый инфаркт миокарда, около 9% имели сопутствующую ХОБЛ, при этом у больных ХОБЛ наблюдалась 30% летальность, в то время как при отсутствии ХОБЛ она составила 19%. Более 27% пациентов ХОБЛ в этом исследовании страдали сердечной недостаточностью до включения в исследование [312]. В другом крупном исследовании, проанализировавшем 400000 госпитализаций пациентов ХОБЛ в отделения ветеранов, сопутствующая патология коронарных артерий встречалась в 33,6% случаев [313].
Патогенетически столь частая ассоциация ХОБЛ, ИБС, сердечной недостаточности и аритмий определяется целым рядом обстоятельств: Во-первых, это общий доминирующий фактор риска – курение. Во-вторых, оба вида патологии являются зависимыми от возраста, заболеваемость ими прогрессивно нарастает после 50 лет. В третьих, – ремоделирование правых отделов сердца является ответом на развивающуюся легочную гипертертензию. В четвертых, – системное воспаление, окислительный стресс, гиперкапния, характерные для ХОБЛ, ведут к ускорению процессов атерогенеза и являются провокаторами аритмий.
И наконец, имеет место взаимное негативное влияние медикаментозной терапии, когда препараты для лечения сердечной патологии могут ухудшить течение ХОБЛ, а бронхолитики – провоцировать жизнеугрожающие аритмии.
Стратификация риска
При определении степени риска ВСС у пациента с ХОБЛ необходимо учитывать два основных фактора:
– степень ограничения воздушного потока, определяемую при спирометрии;
– анамнез пациента, прежде всего указания на наличие сопутствующих или перенесенных заболеваний, увеличивающих у больных ХОБЛ риск ВСС, а также лекарственный анамнез.
Пациенты с величиной ОФВ1 больше 60% не имеют дополнительных рисков развития ВСС, поэтому их ведение не отличается от ведения других пациентов не страдающих ХОБЛ.
У больных со снижением ОФВ1 ниже 60%, но отсутствием факторов риска в анамнезе целесообразно периодически проводить холтеровское мониторирование ЭКГ для своевременного выявления скрытой кардиальной патологии.
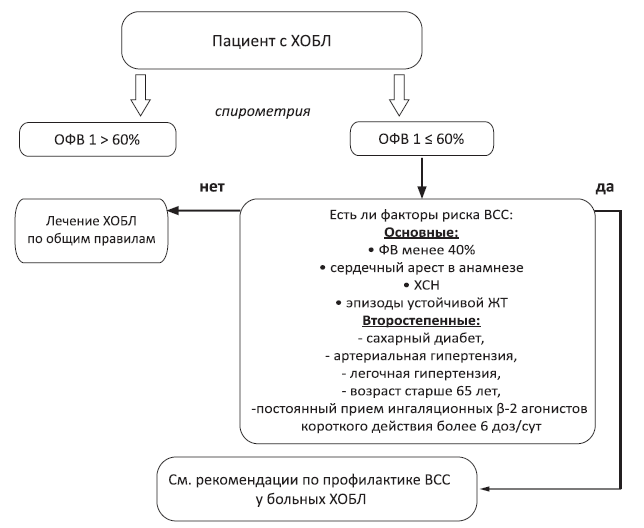
Рис. VII.9.1. Стратификация риска ВСС у пациентов с ХОБЛ
Наибольшего внимания в отношении профилактики ВСС требует группа пациентов с ХОБЛ, у которых сочетаются сниженная величина ОФВ1<60% и наличие заболеваний сердечно-сосудистой системы. В этом случае необходимо рассмотреть возможность внесения изменений в план ведения пациента с целью профилактики ВСС в соответствии приведенными ниже рекомендациями (рис. VII.9.1).
Рекомендации по профилактике ВСС
Класс I
1. Особенности профилактики ВСС у больных с ХОБЛ базируются на выявлении основных и второстепенных факторов риска. Это подразумевает, в том числе, имплантацию ИКД пациентам, имеющим основные факторы риска ВСС, которые получают длительную оптимальную лекарственную терапию, с хорошим функциональным статусом* и благоприятным прогнозом выживаемости в течение года и более (В).
2. При использование бета-блокаторов, предпочтение должно отдаваться селективным препаратам, блокирующим β-1 рецепторы (А).
Класс IIа
1. У больных с ХСН наиболее предпочтительным препаратом, не приводящим к снижению ОФВ1 (основной фактор риска) и качества жизни, является бисопролол (В).
2. Пациенты ХОБЛ стабильного течения, принимающие теофиллин и β-2 агонисты длительного действия не имеют повышенного риска ВСС (B).
Класс IIb
1. Ингаляционные кортикостероиды уменьшают риск развития ВСС у больных ХОБЛ (B).
2. Пожилые больные ХОБЛ, старше 65 лет имеют меньший риск развития ВСС при приеме ингаляционных β-2 агонистов длительного действия, чем при использовании ингаляционных антихолинергических препаратов длительного действия (B).
3. Применение порошковой ингаляционной формы тиотропиума не увеличивает риск ВСС у больных ХОБЛ (B).
Класс III
1. Следует избегать назначения высоких доз β-2 агонистов пациентам с нестабильной стенокардией (A).
2. Применение 14-членных макролидов (эритромицина, кларитромицина) может сопровождаться удлинением интервала QT и увеличением риска возникновения желудочковых аритмий (основной фактор риска ВСС) (B).
3. Назначение ингаляционного ипратропиума бромида пациентам с ХОБЛ ассоциируется с увеличением риска ВСС (B).
4. Больные ХОБЛ и ХСН, получающие ингаляционные β-2 агонисты короткого действия, имеют более высокий риск ВСС по сравнению с лицами не принимающими подобные препараты (А).
5. Решение о проведении аорто-коронарного шунтирования у больных ХОБЛ с ОФВ1 < 60% должно приниматься с учетом того факта, что у данной категории пациентов риск смерти в послеоперационном периоде достоверно выше (B).
VII.10. ВСС при нейромышечных заболеваниях
Наследственные нейромышечные заболевания (миотоническая мышечная дистрофия, синдром Кернса–Сейра, миодистрофия Эрба, миопатия Эмери–Дрейфуса, другие виды миопатий) могут предрасполагать к развитию предсердных аритмий, нарушений проводимости, АВ-блокаде, мономорфной ЖT или полиморфной ЖТ и ВСС [314–320]. Клинические проявления, указывающие на возможность наличия субстрата для развития ВСС, довольно разнообразны. ВСС является хорошо прогнозируемым выявляемым осложнением некоторых нейромышечных заболеваний, однако прогрессирование нарушений проводимости может быть непредсказуемым [321–330]. В случае поражения сердца, в частности, при мышечной дистрофии, необходимо обращать внимание на минимальные клинические симптомы или электрокардиографические проявления при определении показаний к имплантации ЭКС или ИКД и проведению эндоЭФИ.
Рекомендации по профилактике ВСС
Класс I
1. Существующая стратификация риска ВСС у пациентов с нейромышечными заболеваниями подразумевает выявление основных и второстепенных факторов риска. Принципы профилактики ВСС не отличаются от тех, которые применяются при лечении пациентов без этих расстройств (А).
Класс IIb
1. Имплантация ЭКС может обсуждаться у пациентов с наследственными прогрессирующими нерйромышечными заболеваниями (например, миотоническая дистрофия, синдром Кернса–Сейра, миодистрофия Эрба, миопатия Эмери–Дрейфуса и т.д.) с наличием такого фактора риска ВСС как АВ-блокада (в том числе АВ-блокады I степени), который является основным у этой группы пациентов, даже при отсутствии клинической симптоматики. Это обусловлено тем, что у больных данной категории возможно острое прогрессирование нарушений АВ-проводимости (B).
VII.11. ВСС у пациентов с каналопатиями и синдромом ранней реполяризации желудочков
Синдром удлиненного интервала QT, синдром укороченного интервала QT, синдром Бругада и катехоламинергическая полиморфная желудочковая тахикардия, являются редкими наследственными заболеваниями, вызванными нарушением работы ионных каналов (каналопатиями). Патогенетически близким к вышеозначенным заболеваниям следует считать синдром ранней реполяризации желудочков (СРРЖ). Однако, строго говоря, отнесение последнего к рубрике каналопатий до настоящего времени не учреждено. Они обусловлены мутацией(-ями) генов, кодирующих либо строение порообразующих белков, либо специфических связывающих и строительных белков ионных каналов, а также рецепторов и ферментов, которые являются ключевыми структурно-функциональными компонентами нормальной или абнормальной электрофизиологической системы сердца.
Клиническая значимость каналопатий обусловлена тем, что все они сопряжены с генетически детерминированным высоким риском возникновения ВСС при отсутствии структурных аномалий сердца.
VII.11.A. Синдром удлиненного интервала QT
Синдром удлиненного интервала QT (LQTS) – наследственное заболевание, характеризующееся патологическим удлинением интервала QT на ЭКГ покоя (QTc > 460 мс у женщин и QTc > 440 мс у мужчин), синкопальными состояниями и высоким риском ВСС вследствие развития полиморфной желудочковой тахикардии типа пируэт («torsades de pointes»).
Существует несколько классификаций LQTS – по механизму наследования и сопутствующим клиническим проявлениям выделяют 2 типа синдрома:
1 тип – синдром Романо–Уорда (RWS), обусловлен мутациями в 12-ти различных генах, передается аутосомно-доминантным путем.
2 тип – синдром Джервелла–Ланге–Нильсена (JLNS), обусловлен мутациями в 2-х генах, передается аутосомно-рецессивным путем.
Является причиной приблизительно 1% всех случаев врожденной глухонемоты. Врожденная глухота является обязательным отличительным признаком, она двусторонняя, перцепторного типа, не затрагивает низкий звуковой спектр. Возникает вследствие потери функции Кортиева органа, из-за критического снижения количества ионов калия в омывающей его жидкости. LQTS обнаружен во всех этнических группах.
Врожденный синдром LQT встречается с частотой 1–2:10000 и обуславливает около 3000 летальных исходов ежегодно. Первый тип синдрома (RWS) встречается чаще – 1:5000–7000, второй тип (JLNS) реже 1,6–6:1000000, однако в Дании встречаемость его значительно выше 1:200 000.
В зависимости от клинического варианта течения LQTS выделяют:
1. Изолированное удлинение интервала QT (40%);
2. Синкопе с удлинением интервала QT (38%);
3. Синкопе без удлинения интервала QT (11%);
4. Скрытая форма – «немое», латентное течение (11%), которая предполагает наличие высокого риска синкопе и ВСС без каких либо очевидных фенотипических проявлений заболевания. Последний можно с высокой вероятностью диагностировать только ретроспективно, после внезапной смерти родственников пробанда, считавшихся ранее практически здоровыми.
У мужчин заболевание протекает в более острой и злокачественной форме, что характерно для всех возрастных групп и, особенно, для подростков. Риск развития синкопе и ВСС у женщин возрастает к периоду полового созревания.
LQTS развивается вследствие мутаций в 13 генах, на основании чего выделяют 13 генотипов синдрома LQT. Это мутации в 6-ти генах калиевых каналов (KCNQ1, KCNH2, KCNE1, KCNE2, KCNJ2, KCNJ5), 2-х генах натриевых каналов (SCN5A, SCN4B), 1-ом гене кальциевых каналов (CACNA1C) и 4-х генах специфических связывающих и строительных белков (AKAP9, ANK9, CAV3, SNTA1). В результате либо снижается концентрация ионов калия в клетке, либо увеличенивается концентрации ионов натрия и кальция и нарушается Na/Ca обмен, что способствует увеличению длительности потенциала действия.
Первый генотип синдрома (LQT1) самый распространенный и встречается в 35–50% случаев всех вариантов синдрома LQT и в 90% случаев обусловливает развитие синдрома Джервела–Ланге–Нильсона, в то время как остальные 10% связаны с пятым генотипом (LQT5). Второй генотип синдрома (LQT2) встречается в 25–40% случаев. Шестой генотип синдрома (LQT6) фенотипически сходен с LQT2, но встречается гораздо реже. Третий генотип синдрома (LQT3) встречается в 5–10% случаев. Остальные генотипы являются наиболее редкими формами и встречаются менее чем в 1,5% случаев.
Синдром Андерсена
Синдром Андерсена (или LQT7) – редкое наследственное заболевания, характеризуется периодически развивающимся гипер- и гипокалиемическим параличом, нарушениями развития скелета, дисморфическими признаками, удлиненным интервалом QT, желудочковыми аритмиями, специфическим зубцом Т и часто очень выраженным зубцом U [331, 332]. Синдром связан с мутациями в гене KCNJ2, кодирующем калиевые каналы типа К1.
Жизнеугрожающие ЖА достаточно редки у больных с синдромом Андерсена, но, несмотря на это были описаны эпизоды внезапной смерти [332–334]. Опыт лечения невелик. У молодой женщины с синдромом Андерсена и мутацией R218W в гене KCNJ2 лечение амиодароном и ацетазоламидом вызвало продолжительное улучшение кардиологических и мышечных симптомов. Периодический паралич в большинстве случаев может быть предотвращен приемом препаратов калия per os [335]. Положительный эффект от β-адреноблокаторов у этой категории больных не доказан. Данные о положительном влиянии блокаторов кальциевых каналов в отношении аритмии также основаны на клиническом описании одного единственного случая. Сообщается об эффективности антиаритмического лечения препаратами I C класса – флекаинидом [336, 337] и этацизином [338].
Синдром Тимоти
Синдром Тимоти (или LQT8) – редкое наследственное заболевание, характеризуется удлинением интервала QT, фатальными аритмиями, синдактилией, гипогликемией, гипотермией, замедлением умственного развития, врожденными пороками сердца, иммунным дефицитом, врожденными аномалиями развития и аутизмом. Описана преходящая AВ блокада типа 2:1, возникающая вследствие увеличения длительности периода реполяризации желудочков, а не вследствие нарушения проводимости в АВ-соединении [339, 340]. Синдром Тимоти ассоциирован с мутациями в гене CACNA1C, кодирующем β1-субъединицу кальциевых каналов. Мутация способствует развитию внутриклеточной перегрузки ионами кальция во всех тканях [341].
Генетические особенности синдрома LQT
1. 2 из 5 носителей мутантных аллелей не имеют удлинения QT.
2. Пенетрантность низкая и различна у разных типов синдрома LQT1<LQT2<LQT3.
3. Пенетрантность существенно увеличивается при применении средств, удлиняющих интервал QT.
4. Бессимптомные носители патологических аллелей имеют меньший риск фатальных аритмий, но этот риск существенно повышается в случае приема лекарств, удлиняющих интервал QT. Примерно у 20% больных, имеющих вторичное удлинение QT, выявляются специфические для LQTS мутации.
5. Корреляция между генотипом и фенотипом имеется только у LQT1-LQT8.
6. Высокая генетическая гетерогенность: 13 генов, более 760 мутаций.
7. Наследуется преимущественно аутосомно-доминантным путем, а LQT1 и LQT5 еще и аутосомно-рецессивным.
8. 5–10% случаев синдрома LQT развивается вследствие спонтанных спорадических мутаций.
9. 20–25% случаев синдрома LQT являются генетически неуловимыми, что требует поиска новых причинных мутаций.
10. У ряда больных фиксируются мутации сразу в нескольких генах, что приводит к более выраженным клиническим проявлениям заболевания.
В настоящее время есть технические возможности исследования полной последовательности кодирующей части соответствующего гена [342–344].
Таблица VII.11.1
Стратификация риска у больных с врожденным синдромом LQT
| Риск кардиальных событий к 40 годам | QTc в покое | Генотип | Пол |
|---|---|---|---|
| Высокий (>50%) | > 500 мс | LQT1 LQT2 LQT3 |
муж/жен муж/жен муж |
| Средний (30-49%) | > или < 500 мс < 500 мс |
LQT3 LQT3 LQT2 |
жен муж жен |
| Низкий (<30%) | < 500 мс | LQT2 LQT1 |
муж муж/жен |
Стратификация риска
На основании знания генотипа, пола и значении интервала QT производится стратификация риска развития синкопе, желудочковых аритмий и ВСС (таблица VII.11.1). [345, 346]. Проведение теста с физической нагрузкой, который у больного с синкопальным состоянием в анамнезе провоцирует развитие полиморфной желудочковой тахикардии и/или выраженное (более 520 мс) удлинение коррегированного интервала QT и альтерацию зубца Т, является дополнительным фактором, утверждающим риск развития жизнеугрожающих аритмий [347]. Есть единичные данные, которые указывают, что тип мутации может иметь существенное значение в определении прогноза больного и может быть основанием для превентивой имплантации ИКД . Это касается мутации А341V гена KCNQ [348]. Больные JLNS, синдромом Тимоти и другими гомозиготными синдромами, подвержены наиболее высокому риску ВСС уже в детском возрасте. У больных, реанимированных после ВСС, наиболее неблагоприятный прогноз с относительным риском повторной остановки сердца, равным 12,9. Расположение мутации в порообразующем регионе белка считается независимым генетическим фактор риска ВСС, сопоставимым с удлинением QTc>500 мс [349]. Риск смерти у бессимптомных носителей мутаций, приводящих к развитию LQT1, максимален в молодом возрасте [350].
Рекомендации по генетическому тестированию
Класс I
1. Рекомендовано выполнять генетическое тестирование на наличие врожденного синдрома удлиненного интервала QT всем детям и подросткам с удлинением интервала QT на ЭКГ покоя (QTc > 460 мс у лиц женского пола и QTc > 440 мс у муского), имеющим основные факторы риска ВСС (необъяснимые синкопе, сердечный арестом в анамнезе, семейный анамнез ВСС), а также детям, страдающим эпилепсией без эффекта от специфической терапии (В).
Класс IIа
1. Генетическое тестирование рекомендовано всем больным, имеющим высоковероятный диагноз LQTS, основанный на данных анамнеза, ЭКГ-фенотипировании заболевания (на основании выполненных 12-канальной ЭКГ в покое и/или в ходе проведения функциональных проб с физической нагрузкой или инфузией катехоламинов) (С).
2. Генетическое тестирование рекомендовано всем бессимптомным больным, у которых на серии 12-канальных ЭКГ покоя выявляется QTc>480 мс (дети) или QTc>500 мс (взрослые) в отсутствии заболеваний или состояний, способных вызвать удлинение интервала QT (таких, как электролитные нарушения, гипертрофия миокарда, блокада ножек пучка Гиса и т.д.) (С).
3. Если генетическое исследование у пробанда привело к выявлению мутации, ответственной за LQTS родственникам первой и второй степени родства, независимо от клинического фенотипа, показано селективное генетическое тестирование (С).
Класс IIb
1. При выявлении удлинения QT, вызванного применением лекарственных препаратов, генетическое тестирование предоставляет возможность выявить носительство мутаций, ответственных за первичные формы LQTS (В).
2. Если отсутствует возможность тестирования всех известных мутаций, возможно проведение селективного анализа генов, ответственных за LQT1-3 (KCNQ1, KCNH2, SCN5A) (С).
3. Для родственников больных 1–2 степени с вторичным синдромом удлиненного интервала QT рекомендуется выполнение 12-канальной ЭКГ покоя (С).
Профилактика ВСС
Изменения образа жизни. Если генотип синдрома установлен, то изменение образа жизни рекомендуется проводить с учетом влияния специфических триггерных механизмов фатальных исходов [345, 351–354].
Больным с LQT1 и LQT5 рекомендуется максимально ограничить физические нагрузки, особенно состязательную спортивную деятельность [355], плавание, спринт, танцы или осуществлять их под наблюдением врача.
Больным с LQT2 и LQT6 следует избегать воздействия сильных эмоций (страх, злость, плач, экзамены), внезапных акустических стимулов (будильник, сигнал автомобиля, звонок телефона), особенно во время сна. Для них также является высоко рисковым в отношении развития кардиальных событий (ЖА, ВСС) послеродовый период. Кроме того, тригерром может явиться прием лекарств, удлиняющих интервал QT [356]*. Следует избегать приема пищевых добавок с неопределенным химическим составом.
Лечение. На основании знания генотипа синдрома LQT осуществляется подбор индивидуальной терапевтической стратегии, включая не только рекомендации по изменению образа жизни, но и по применению специфических лекарственных препаратов и имплантации ИКД [342, 357–359].
Своевременно назначенная медикаментозная терапия (преимущественно бета-блокаторы) предотвращает синкопе более чем у 87% больных. Однако β-аденоблокаторы менее эффективны у больных с генотипом LQT2 и вообще не эффективны (и даже противопоказаны) у больных с генотипом LQT3 [360].
* – перечень медикаментов содержится на сайте www.qtdrug.org.
Имплантация ИКД является методом выбора для лечения таких больных при эпизодах сердечного ареста в анамнезе и при неэффективности консервативной терапии [342, 360].
Хирургическое удаление левого звездчатого ганглия, проведенное с целью устранения ассиметричной симпатической вегетативной иннервации сердца, являющейся аритмогенным фактором, приводит к некоторому укорочению интервала QT [361].
Бессимптомным носителям мутаций может быть рекомендован профилактический прием бета-блокаторов [358, 359].
Рекомендации по профилактике ВСС
Класс I
1. Больным с установленным диагнозом (клинически и/или с помощью молекулярно-генетического исследования) синдрома удлиненного интервала QT рекомендуется изменение образа жизни (В).
2. Больные с установленным диагнозом (клинически и/или установленным с помощью молекулярно-генетического исследования) синдрома удлиненного интервала QT не должны принимать лекарственные
препараты, которые вызывают удлинение интервала QT (В).
3. В целях первичной профилактики ВСС больным с диагнозом синдрома удлиненного интервала QT (LQT3), установленным с помощью молекулярно-генетического исследования, рекомендуется имплантация ИКД (В).
4. В целях вторичной профилактики ВСС пациентам с диагнозом синдрома удлиненного интервала QT (LQT1, LQT2, LQT5 и LQT6), установленным с помощью молекулярно-генетического исследования,
имеющим указания в анамнезе на эпизод сердечного ареста (основной фактор риска) рекомендуется имплантация ИКД (В).
Класс IIa
1. Бета-адреноблокаторы рекомендуются пациентам с диагнозом синдрома удлиненного интервала QT (LQT1 и LQT5), установленным с помощью молекулярно-генетического исследования (В).
2. Назначение препаратов калия рекомендуется пациентам с диагнозом синдрома удлиненного интервала QT (LQT2 и LQT6), установленным с помощью молекулярно-генетического исследования (В).
3. Назначение ААП IB класса рекомендуется пациентам с диагнозом синдрома удлиненного интервала QT (LQT3), установленным с помощью молекулярно-генетического исследования.
4. Имплантация ИКД оправдана пациентам с клиническим диагнозом синдрома удлиненного интервала QT с наличием основных факторов риска ВСС (синкопе и/или желудочковые аритмии) на фоне приема β-адреноблокаторов (B).
Класс IIb
1. Блокаторы кальциевых каналов и ААП IB класса могут быть назначены пациентам с диагнозом синдрома удлиненного интервала QT (LQT2 и LQT6), установленным с помощью молекулярно-генетического
исследования (В).
2. Бессимптомным носителям причинных мутаций может быть рекомендован профилактический прием бета-блокаторов (B).
3. Левосторонняя симпатэктомия может обсуждаться у больных с клиническим диагнозом синдрома удлиненного интервала QT, имеющих основные факторы риска ВСС (указания в анамнезе на эпизод сердечного ареста, ЖТ по типу «пируэт») на фоне приема бетаадреноблокаторов (B).
Класс III
1. Назначение бета-блокаторов и никорандила противопоказано больным с диагнозом синдрома удлиненного интервала QT (LQT3), установленным с помощью молекулярно-генетического исследования (С).
VII.11.Б. Синдром укороченного интервала QT
Синдром укороченного интервала QT (SQTS) – генетически обусловленное заболевание, характеризующееся укорочением, как абсолютного (QT ≤ 300 – 340 мс), так и корригированного (QTc < 320 мс) значения интервала QT, высоким, симметричным, остроконечным зубцом Т и большим спектром нарушений сердечного ритма от ФП до ЖА.
Обморок и ВСС обычно случаются в состоянии покоя или во сне. Обморок при синдроме SQT встречается менее часто, чем ВСС, которая является первым проявлением заболевания у большинства пациентов.
Диагностические критерии SQTS [362], основанные на бальной оценке клинических данных и данных генотипирования, представлены в таблице VII.11.2.
Таблица VII.11.2
Диагностические критерии SQTS
| Диагностические критерии | Баллы |
| Длинна QTс, ms <370 | 1 |
| <350 | 2 |
| <330 | 3 |
| Интервал от точки J до максимального уровня (пика) T <120 ms | 1 |
| Анамнез | |
| Сердечный арест в анамнезе | 2 |
| Документированная ЖТ или фибрилляция желудочков | 2 |
| Синкопе без явных причин | 1 |
| Мерцательная аритмия | 1 |
| Семейный анамнез | |
| Родственники 1-й и 2-й линии родства, имеющие высоковероятный SQTS | 2 |
| Внезапно необъяснимо умершие родственники 1-й и 2-й линии родства | 1 |
| Синдром младенческой внезапной смерти | 1 |
| Генотип http://www.sciencedirect.com/science/article/pii/S0735109710047212 – tblfn5 | |
| Выявлена описанная ранее мутация | 2 |
| Мутация неизвестной значимости, выявленная в генах KCNH2, KCNQ1, KCNJ2 | 1 |
| Оценка вероятности диагноза SQTS | |
| Наличие STQS высоковероятно | 4 и более |
| Наличие STQS вероятно | 3 |
| Наличие STQS маловероятно | 1-2 |
При этом синдроме отмечается ослабление адаптации интервала QT к изменениям ЧСС, и поэтому его измерения целесообразно осуществлять при ЧСС около 60 в минуту для исключения искажения
результатов, вносимых формулой коррекции Базетта. Необходимо 96 Vii . Стратификация риска и профилактика всс Vii . Стратификация риска и профилактика всс 97 исключение вторичного характера изменений, так как к укорочению интервала QT могут приводить такие состояния как гиперкальциемия, гипокалиемия, интоксикация сердечными гликозидами, ацидоз, гипо- или гипертермия, прием некоторых ААТ (микселитин, токаинид). Распространенность SQTS не известна.
За развитие типичных клинических проявлений врожденного синдрома SQT ответственны мутации в 5 различных генах, на основании чего выделяют 5 генотипов синдрома SQT. Это мутации в 3-х генах калиевых каналов (KCNQ1, KCNH2, KCNJ2) и 2-х генах кальциевых каналов (CACNA1C, CACNB2B). Следствием этих мутаций является либо увеличение концентрации ионов калия в клетке, либо уменьшение концентрации ионов кальция, что приводит к укорочению потенциала действия в кардиомиоцитах. Генотипы синдрома SQT, связанные с мутациями в генах кальциевых каналов обязательно фенотипически сочетаются с синдромом Бругада. Применение хинидина может восстанавливать продолжительность QT [363]. Единственным методом профилактики ВВС является имплантация ИКД [364].
Генетический анализ, по-видимому, не несет дополнительной информации в отношении риска развития ВВС.
Генетические особенности SQTS
1) низкая пенетрантность;
3) возможно бессимптомное носительство патологических аллелей;
4) корреляция между генотипом и фенотипом отсутствует;
5) высокая генетическая гетерогенность: 5 генов, более 5 мутаций;
6) наследуется аутосомно-доминантным путем;
7) возможны спорадические случаи.
Рекомендации по генетическому тестированию
Класс IIa
1. Генетическое тестирование следует выполнять для уточнения диагноза у больных с низкой и промежуточной вероятностью наличия SQTS (С).
Класс IIb
1. Тестирование родственников больного рекомендовано при выявлении патогенетической мутации у пробанда (С).
Рекомендации по профилактике ВСС
Класс I
1. В целях вторичной профилактики ВСС больным с диагнозом синдрома укороченного интервала QT при наличии основных факторов риска ВСС (сердечный арест в анамнезе, синкопе, индуцированные в ходе проведения эндоЭФИ устойчивые гемодинамически значимые ЖНР) рекомендована имплантация ИКД (С).
Класс IIa
1. Пациентам с высоковероятным диагнозом SQTS рекомендуется имплантация ИКД (B).
2. Назначение хинидина может быть эффективным для снижения риска ВСС у пациентов с синдромом укороченного интервала QT, если возможность имплантации ИКД отсутствует (С).
VII.11.B. Синдром Бругада
Синдром Бругада (BrS) – генетически обусловленное заболевание, развивающееся вследствие аномальной электрофизиологической активности эпикарда правого желудочка в области выносящего тракта.
Синкопе и ВСС при синдроме Бругада часто возникают в состоянии покоя или во время сна.
Синдром Бругада характеризуется специфическим ЭКГ-паттерном:
– постоянная или транзиторная блокада правой ножки пучка Гиса;
– подъём сегмента ST (точки J) в отведениях V1–V3 (выделяют три ЭКГ-типа);
– инвертированный зубец Т в отведениях V1–V3;
– периодическое удлинение интервала PQ;
– пароксизмы ЖТ во время синкопе;
– «эпсилон» – волна в отведении V1 в виде «зазубрины» на сегменте ST (в 30% случаев).
Точная степень распространенности синдрома Бругада неизвестна.
В среднем в мире врожденный синдром Бругада встречается с частотой 1–60:10 000, в Европе 1:10 000, причем в одной из областей Бельгии 1:100 000. В Европе синдром Бругада чаще выявляется у представителей «кавказского» этнического типа (выходцы из стран Восточной Европы). В странах Юго-Восточной Азии и Дальнего Востока > 5 на 10 000, особенно в Таиланде, на Филиппинах и Японии. В Таиланде ежегодно умирают от этого синдрома ~ 2500 человек. В России частота регистрации этого заболевания примерно соответствует европейской [365]. Известно, что синдром Бругада не зарегистрирован у афро-американцев.
Описано несколько клинических вариантов синдрома Бругада:
1. Классические изолированные изменения на ЭКГ;
2. Синкопе со специфическими изменениями на ЭКГ;
3. Синкопе без специфических изменений на ЭКГ;
4. Скрытая форма – «немое», латентное течение.
За развитие типичных клинических проявлений врожденного синдрома Бругада ответственны мутации в 8 различных генах, на основании чего выделяют 8 генотипов синдрома Бругада. Это мутации в 3-х генах натриевых каналов (SCN5A, SCN1B, SCN3B), 2-х генах калиевых каналов (KCNE3, KCNJ8), 2-х генах кальциевых каналов (CACNA1C, CACNB2B) и одном гене глицерол-3-фосфат дегидрогеназы 1 типа (GPD1L). Следствием этих мутаций является либо снижение концентрации ионов натрия и кальция в клетке, либо увеличение концентрации ионов калия, что способствует селективному укорочению потенциала действия эпикарда правого желудочка [342, 366]. В России имеется ограниченный опыт генотипирования больных с синдромом Бругада, однако как минимум в трети случаев имеют место мутации в гене SCN5A, при этом все выявленные мутации ранее не регистрировались [367].
Стратификация риска
Предикторами неблагоприятного исхода при синдроме Бругада являются мужской пол, синкопе или внезапная смерть в семейном анамнезе, спонтанный подъем сегмента ST в отведениях V1–V3 в комбинации с синкопе, спонтанные изменения сегмента ST и первый ЭКГ-тип синдрома.
В ходе проведения эндоЭФИ у больных с синдромом Бругада могут индуцироваться гемодинамически значимые желудочковые тахиаритмии, которые нередко верифицируются больными как клинические. Тем не менее, эндоЭФИ нельзя считать «золотым стандартом» при проведении стратификации риска ВСС, диагностическая ценность этого исследования невелика [368].
Данных, касающихся рутинного применения генотипирования для оценки риска ВВС нет. В одной из работ было показано, что наличие мутаций в гене SCN5A, сопровождающиеся потерей функции этого ионного канала, может свидетельствовать о неблагоприятном прогнозе [369].
Генетические особенности синдрома Бругада:
1. Низкая пенетрантность (~25%);
2. Использование блокаторов натриевых каналов (аймалин) для идентификации пораженных людей увеличивает пенетрантность до 80%;
3. Возможно бессимптомное носительство патологических аллелей;
4. Корреляция с фенотипом имеется не при всех генотипах;
5. Высокая генетическая гетерогенность: 8 генов, более 400 мутаций;
6. Наследуется аутосомно-доминантным путем.
7. Только у 25% пациентов обнаруживаются описанные мутации.
Рекомендации по генетическому тестированию
Класс I
1. Рекомендовано выполнять генетическое тестирование на врожденный синдром Бругада всем детям и подросткам при наличии специфического ЭКГ-паттерна, у которых имеются такие основные факторы риска ВСС, как эпизоды синкопе, сердечный арест в анамнезе, ЖНР, случаи ВСС в семье (B).
Класс IIb
1. Идентификация типа мутации в гене SCN5A может дать дополнительную информацию по поводу риска развития ВВС (В).
2. Тестирование родственников больного рекомендовано при условии выявления патогенетической мутации у пробанда.
Класс III
1. Генетическое тестирование не показано бессимптомным пациентам при наличии бругадоподобного ЭКГ-паттерна 2 или 3 типа.
Рекомендации по профилактике ВСС
Класс I
1. Пациентам с диагнозом синдрома Бругада, установленным клинически и/или на основании молекулярного анализа, имеющим указания на эпизод сердечного ареста в анамнезе (основной фактор риска ВСС), рекомендована имплантация ИКД (C).
Класс IIa
1. Пациентам с синдромом Бругада со спонтанным подъемом сегмента ST в отведениях V1–V3, имеющим указания в анамнезе на эпизоды синкопе (основной фактор риска ВСС) и верифицированными причинными мутациями в гене SCN5A, рекомендована имплантация ИКД (C).
2. Клинический мониторинг частоты спонтанного подъема сегмента ST целесообразно проводить у пациентов, как с клиническими проявлениями заболевания, так и без них, у которых подъем сегмента ST возникает только в результате выполнения провокационных фармакологических проб (C).
3. Имплантация ИКД показана пациентам с синдромом Бругада и хорошим функциональным статусом, благоприятным прогнозом выживания в течение года и более, у которых была верифицирована ЖТ, не
приведшая к остановке сердечно-сосудистой деятельности (C).
Класс IIb
1. Проведение эндоЭФИ может обсуждаться для стратификации риска у пациентов с синдромом Бругада со спонтанным подъемом сегмента ST, без мутации в гене SCN5A и каких-либо клинических проявлений (C).
2. Хинидин может применяться для уменьшения выраженности элевации сегмента ST и лечения «аритмического шторма» у пациентов с синдромом Бругада (C).
Класс III
1. Больным с синдромом Бругада противопоказано назначение ААП IС класса (включая флекаинид и пропафенон) и IА класса (включая прокаинамид и дизопирамид).
VII.11.Г. Катехоламинергическая полиморфная желудочковая тахикардия
Катехоламинергическая полиморфная желудочковая тахикардия (КПЖТ) – это наследственный синдром, характеризующийся электрической нестабильностью кардиомиоцитов, возникающей вследствие острой активации симпатической нервной системы (на фоне физической или эмоциональной нагрузки) и приводящий к внезапной смерти.
На ЭКГ покоя вне приступа не имеется каких-либо патологических изменений. Аритмия может быть воспроизведена при проведении теста с физической нагрузкой или медикаментозных проб с внутривенным введением катехоламинов. Соответственно, больным КПЖТ требуется ограничение физической нагрузки, таким людям категорически запрещено заниматься спортом [370].
Для детей со злокачественной, синкопальной формой КПЖТ, выявлен ряд особенностей синусового ритма, которые могут способствовать
раннему, доклиническому выявлению больных с КПЖТ в популяции.
Эти особенности составляют характерный ЭКГ-паттерн:
– постоянное или транзиторное укорочение интервала PQ (< 0,11с) без других ЭКГ проявлений WPW-синдрома;
– синусовая брадикардия;
– высокий циркадный индекс при ХМ-ЭКГ (> 1,45).
Выделяют 2 генотипа КПЖТ. Первый генотип КПЖТ (CVPT1) связан с мутациями в гене рианодиновых рецепторов RYR2, второй генотип КПЖТ (CVPT2) связан с мутациями в гене кальсеквестрина-2 (CASQ2).
В результате происходит усиленное высвобождение ионов кальция из саркоплазматического ретикулума в ответ на вход ионов кальция в клетку, вызывая перегрузку клеток ионами кальция, что вызывает обратное направление активации стенки желудочков, усиливает трансмембранную дисперсию реполяризации и запускает ЖТ по механизму повторного входа электрического возбуждения, т.е. ре-ентри [371, 372].
Бета-блокаторы иногда не предотвращают аритмии. Есть указания на эффективность применения верапамила, возможно непосредственно взаимодействующего с рианодиновыми рецепторами.
В развитии КПЖТ предполагается участие и других генов. Считается, что мутация в гене KNJ2 связана не только с развитием синдрома Андерсена/LQT7, но и с причиной КПЖТ 3 генотипа (CPVT3.) У одного больного с КПЖТ описана мутация в гене анкирина-В, которая также имеет место при развитии синдрома удлиненного интервала QT 4 типа [373]. Возможно, мутации в гене RYR2 обуславливают так называемый синдром внезапной смерти у младенцев [342]. В последнее время имеются предположения, что идиопатическая фибрилляция желудочков
может являться одной из форм данного заболевания (КПЖТ).
Стратификация риска
К факторам риска ВСС в данной категории пациентов относятся:
зарегистрированная ФЖ, семейный анамнез ВСС, появление симптомов в детском возрасте, наличие в анамнезе обморочных состояний, физическая активность.
Генетические особенности синдрома КПЖТ
1. Низкая пенетрантность.
3. Возможно бессимптомное носительство патологических аллелей.
4. Корреляция между генотипом и фенотипом отсутствует.
5. Высокая генетическая гетерогенность: 4 гена, более 170 мутаций.
6. Наследуется преимущественно аутосомно-доминантным путем, реже аутосомно-рецессивным путем.
Рекомендации по генетическому тестированию
Класс I
1. Рекомендовано выполнять генетическое тестирование на врожденный синдром КПЖТ всем детям и подросткам с такими факторами риска ВСС как индуцированные физической или сильной эмоциональной нагрузкой полиморфная ЖТ, синкопе, сердечный арест, а так же лицам, имеющим в семейном анамнезе указания на ВСС (B).
2. Генетическое тестирование рекомендовано больным с высокой вероятностью диагноза КПЖТ, основанном на данных анамнеза, семейной истории, электрокардиографическом фенотипе заболевания, результатах стресс-тестов с физической нагрузкой (тредмил-тест) или введении катехоламинов (C).
Класс IIb
1. Генетическое тестирование родственников 1–2 степени родства рекомендовано при условии выявления патогенетической мутации у пробанда.
Рекомендации по профилактике ВСС
Класс I
1. Пациентам с установленным диагнозом КПЖТ (клинически и/или с помощью молекулярно-генетического исследования) рекомендуется изменение образа жизни (максимальное ограничение физических нагрузок, соревновательной спортивной деятельности, сильныхэмоций) (B).
2. Пациентам с диагнозом КПЖТ, установленным клинически, рекомендуется назначение бета-блокаторов (С).
3. В целях вторичной профилактики ВСС пациентам с установленным диагнозом КПЖТ (клинически и/или с помощью молекулярногенетического исследования), имеющих основной фактор риска как указания в анамнезе на сердечный арест, рекомендуется имплантация ИКД и назначение бета-блокаторов (С).
Класс IIa
1. В целях вторичной профилактики ВСС пациентам с установленным диагнозом КПЖТ (клинически и/или с помощью молекулярногенетического исследования), имеющим такой основной фактор риска как указание в анамнезе на сердечный арест, развившейся на фоне терапии бета-блокаторами, рекомендуется имплантация ИКД (С).
Класс IIb
1. Пациентам с установленным в детском или зрелом возрасте диагнозом КПЖТ (с помощью молекулярно-генетического исследования) при отсутствии клинических проявлений рекомендуется назначение
бета-блокаторов (С).
VII.11.Д. Синдром ранней реполяризации желудочков
Синдром ранней реполяризации желудочков (СРРЖ) впервые был описан в 1936 году, однако его прогностическое значение до сих пор не определено [374]. СРРЖ характеризуется следующими электрокардиографическими проявлениями: 1) горизонтальным или нисходящим подъемом сегмента ST > 0,1 мВ с выпуклостью, направленной книзу; 2) наличием точки соединения (junction point) или волны соединения (J wave) на нисходящем колене зубца R; 3) поворотом электрической оси сердца против часовой стрелки по продольной оси; 4) быстрым и резким нарастанием амплитуды зубца R в грудных отведениях с одновременным уменьшением или исчезновением зубца S.
До 2008 года большинство авторов сходились во мнении, что СРРЖ не более чем доброкачественный электрокардиографический феномен [374, 375]. В 2008 году практически одновременно две группы авторов опубликовали исследования случай–контроль, поставившие под сомнение благоприятное прогностическое значение СРРЖ [376, 377].
В обоих исследованиях точка J в 3–6 раз чаще регистрировалась в нижних (II, III, avF) и боковых (V4–6) отведениях у пациентов с идиопатической фибрилляцией желудочков по сравнению со здоровыми лицами, а амплитуда J-волны была выше.
Ретроспективный анализ исследования Social Insurance Institution’s Coronary Heart Disease Study, показал, что в общей популяции наличие J-волны в нижних отведениях ассоциируется с более высоким риском смерти от сердечных причин, но кривые выживаемости начинают расходиться через 15 лет наблюдения [378]. Похожие данные были получены и при ретроспективном анализе немецкой части проекта MONICA [379]. Antzelevitch C. и Yan G-X. предложили новую классификацию СРРЖ, в которой тип 2 и 3 синдрома считается потенциально аритмогенным, а у пациентов с типом 3 существует высокая вероятность развития электрического шторма [380].
Рекомендации по профилактике ВСС
Класс IIa
1. Наличие J-волны в нижних отведениях (II, III, avF) может являться основным фактором риска развития ФЖ (или даже ВСС), а также фактором, увеличивающим предрасположенность к развитию фатальных аритмий во время ишемии миокарда (B).
2. Средством выбора при развитии ЖА (основной фактор риска) или электрического шторма на фоне СРРЖ в нижних отведениях является увеличение ЧСС за счет проведения временной учащающей ЭКС или введения изопротеренола (В).
3. Длительный прием хинидина показан для проведения профилактики ВСС на фоне наличия ЭКГ-признаков СРРЖ в нижних отведениях (В)
VII.12. ВСС при синдроме апноэ
Апноэ во время сна определяют как прекращение движения воздушного потока через носовую и ротовую полости в течение 10 и более секунд [381].
В зависимости от механизма возникновения различают два основных вида апноэ: обструктивное и центральное. В настоящее время является установленным фактом, что около 90% всех эпизодов апноэ во время сна связаны с обструкцией верхних дыхательных путей (ВДП).
В последнее время в клиническую практику, также широко, вошло понятие гипопноэ, которое впервые было описано Block et al. как эпизоды поверхностного дыхания, сопровождаемые десатурацией [382].
Для более точного учета эпизодов дыхательных нарушений во время сна в англоязычной литературе используют также эпизоды RERA, что расшифровывается как «respiratory effort-related arousal» и можно перевести как «ЭЭГ-активация [383] в результате респираторного усилия» (ЭРУ). Таким образом, под ЭРУ подразумевают эпизод дыхательного нарушения, сопровождаемый ЭЭГ-активацией или микропробуждением головного мозга, чаще всего, являющийся результатом повышенного сопротивления верхних дыхательных путей. При этом изменения на каналах регистрирующих дыхание (ороназальный воздушный поток, торакоабдоминальные движения), не должны подпадать под критерии апноэ или гипопноэ [384].
Таким образом, в настоящее время вместо употребляемого ранее «синдром обструктивного апноэ сна» используют «синдром обструктивного апноэ/ гипопноэ сна». В этом случае, название синдрома более точно отражает его патофизиологическую сущность.
В настоящее время стандартом для оценки степени тяжести дыхательных нарушений во время сна является т.н. индекс апноэ/ гипопноэ (ИАГ), который предусматривает количественную оценку эпизодов апноэ, гипопноэ и ЭРУ за один час сна. О синдроме обструктивного апноэ/гипопноэ сна (СОАГС) говорят в том случае, когда ИАГ≥ 5 сочетается с клинической картиной.
В соответствии с Международной классификацией нарушений сна проявления синдрома апноэ во сне обструктивного генеза или СОАГС встречаются, по меньшей мере, у 1–2% всей популяции. В возрастной группе от 30 до 60 лет, 4% мужчин и 2% женщин имеют ИАГ≥5 в сочетании с клинической симптоматикой СОАГС.
Проведение полисомнографического исследования предусматривает объективную оценку не только структуры сна, точное количественное и качественное определение дыхательных нарушений во время сна. В ходе полисомнографического исследования также могут быть выявлены эпизоды синус ареста или преходящей АВ-блокада I–III степени.
В настоящее время СОАГС является независимым предиктором развития артериальной гипертензии [385].
Гипоксемия вследствие апноэ во время сна может приводить к развитию ишемии миокарда [385] и желудочковым аритмиям [386]. У больных СОАГС во время сна отмечаются потенциально фатальные
аритмии [387, 388]. В рандомизированном исследовании 41 больного с СОАГС, получавших «сипап»-терапию, было установлено, что в подгруппе больных у которых осуществлялся переход с лечебного уровня давления на субтерапевтический уровень в течение двух недель (т.е. вновь отмечалось наличие симптомов апноэ сна в связи с неэффективностью низкого уровня давления), отмечено достоверное увеличение интервала QTc и интервала TpTe(с), а также дисперсии реполяризации (TpTe/QT) [389].
Существенна роль СОАГС и в развитии внезапной сердечной смерти во время сна. В отличие от общепризнанного факта, свидетельствующего о том, что пик сердечнососудистой смертности в общей популяции приходится на ранние утренние часы (с 6.00 до 12.00), у больных СОАГС наивысшая частота внезапной сердечнососудистой смертности приходится на ночной период времени (с 00.00 до 6.00) [390].
Апноэ во время сна приводит к развитию остановок синусового узла [390], AВ-блокад различных степеней, вплоть до полной поперечной блокады [391].
В настоящее время средством выбора лечения СОАГС является т.н. nCPAP-терапия (от англ. nasal continuous positive airway pressure)
– метод создания постоянного положительного давления в дыхательных путях. В русскоязычной литературе на протяжении последних лет укоренился созвучный англоязычной аббревиатуре термин – «сипап»-терапия.
Одним из главных преимуществ использования «сипап»-терапии у больных артериальной гипертонией является часто наблюдаемое снижение повышенного АД, а иногда и полная его нормализация [392–394]. При использовании «сипап»-терапии исчезают и остановки синусового узла, которые были ассоциированы с эпизодами дыхательных нарушений, а также в значительной степени уменьшаются и другие нарушения ритма сердца ассоциированные с апноэ во время сна [394]. 7-летнее наблюдение за больными СОАГС выявило достоверное уменьшение внезапной сердечной смерти в группе получавших «сипап»-терапию по сравнению с теми пациентами, которые посчитали данную терапию для себя неприемлемой [395].
Стратификация риска
В таблице VII.12.1. представлен алгоритм стратификации риска ВСС
у пациентов с СОАГС.
Таблица VII.12.1
Стратификация риска ВСС у пациентов с синдром апноэ/гипопноэ сна
| 1.Верифицирован диагноз СОАГС | |
| Да | Нет |
| См. пункт 2 | Стратификация риска и профилактика ВСС на основании общепринятых принципов |
| 2. ИАГ > 15 | |
| Да | Нет |
| Подбор «сипап»-терапии или неинвазивной вентиляции | Снижение веса, коррекция ЛОР патологии, устранение факторов риска СОАГС |
| 3. Есть ли нарушения ритма и проводимости во время ночного или дневного сна при проведении суточного мониторирования ЭКГ | |
| Да | Нет |
| См. рекомендации по профилактике ВСС при СОАГС | Стратификация риска и профилактика |
Примечание: ИАГ – индекс апноэ/гипопноэ, СОАГС – синдром апноэ/гипопноэ сна, ВСС – внезапная сердечная смерть.
ВСС базируется на основании выявления основных и второстепенных факторов риска ВСС и общепринятых принципов профилактики ВСС
Рекомендации по профилактике ВСС
Класс I
1. Стратификация риска и профилактика ВСС у пациентов с СОАГС осуществляется на основании выявления основных и второстепенных факторов риска. Это подразумевает, в том числе, имплантацию ИКД пациентам с хорошим функциональным статусом* и благоприятным прогнозом выживаемости в течение года и более, которые получают длительную оптимальную лекарственную терапию (C).
Класс IIа
1. Больным с брадисистолическими нарушениями ритма сердца ассоциированными с СОАГС показано проведение «сипап»-терапии. Имплантацию ЭКС у таких пациентов следует обсуждать при сохранении брадисистолических нарушений ритма сердца на фоне адекватно проводимой «сипап»-терапии (В).
VII.13. ВСС при желудочковых аритмиях структурно нормального сердца
VII.13.A. Стратификация риска и профилактика ВСС у пациентов с идиопатическими желудочковыми аритмиями
На сегодняшний день понятие «структурно нормального сердца» становиться все более и более условным, т. к. в клиническую практику активно внедряются методы ультраструктурного исследования миокарда, специфические иммунологические тесты, биопсия и проч., применение которых существенно сократило количество пациентов с клинически значимыми желудочковыми нарушениями ритма и неизмененной сердечной мышцей. В действительности, накапливается все больше данных свидетельствующих о том, что причинами возникновения “минимальных изменений миокарда” ПЖ или ЛЖ у пациентов с ЖА могут быть как дебют АДПЖ, так и латентный миокардит, протекающий по аритмогенному варианту, а также некоторые другие, более редкие нозологии [202, 396–400].
Наиболее частой локализацией идиопатических желудочковых аритмий являются базальные отделы сердца, а именно выносящие тракты левого (ВТЛЖ) и правого (ВТПЖ) желудочков сердца и, так называемая, фасцикулярная тахикардия (ФТ), аритмогенный субстрат которой детерминирован местом разветвления задней или средней (значительно реже – передней) ветви пучка Гиса на волокна Пуркинье. Другие локализации аритмогенных зон встречаются значительно реже [202, 401].
* – о методиках проведения оценки функционального статуса вы можете прочитать на сайте http://www.chcr.brown.edu/pcoc/functi.htm.
Дебют аритмического синдрома приходится на возраст до 35 лет, а в случае ФТ – до 25 лет [401].
Идиопатические левожелудочковые аритмии
Наиболее типичной локализацией аритмогенных зон является подклапанная область ВТЛЖ в проекции левого, правого и некоронарного синусов Вальсальвы. Реже встречается эпикардиальная локализация зон аритмии в проекции ствола ЛКА или устья ПМЖВ, а так же приточная часть ЛЖ (ПТЛЖ) под задней или передней створками МК в месте прикрепления поперечных хорд ЛЖ [401].
Характерно преобладание лиц мужского пола с дебютом ЖА до 25 – 30 лет. Клинически аритмия характеризуется доброкачественным течением, с редким развитием гемодинамически значимых пароксизмов ЖТ, однако, в типичных случаях, характерна выраженная эктопическая активность в виде изолированных, парных и групповых экстрасистол и неустойчивой ЖТ на фоне тенденции к синусовой брадикардии. При длительности анамнеза более 5 лет в отсутствии ААТ описаны случаи исхода в аритмогенную кардиопатию [202, 401].
Идиопатические желудочковые аритмии из ВТПЖ
На сегодняшний день большая часть аритмий из ВТПЖ при детальном клиническом анализе оказывается нозологически принадлежащей к группе дебюта АДПЖ или латентно протекающего аритмогенного варианта очагового миокардита [202, 396–400]. Таким образом, сегодня постулат о том, что самой частой локализацией при идиопатических ЖА является ВТПЖ, может быть пересмотрен. Причина – расширение возможностей диагностических методик.
Наиболее типичными локализациями являются перегородочная область ВТПЖ под клапаном легочной артерии (типична для аритмогенного варианта латентного миокардита), реже – переднеперегородочная область под клапаном ЛА и перегородочная область над клапаном ЛА. Другие правожелудочковые локализации (передняя стенка ВТПЖ, приточный тракт, верхушка ПЖ) встречаются значительно реже и почти всегда свидетельствуют о существующей скрытой нозологии (ранние стадии АДПЖ) [202, 396–400].
Клинически аритмия характеризуется доброкачественным течением с редким развитием гемодинамически значимых пароксизмов ЖТ.
Выраженность эктопической активности может варьировать от единичных экстрасистол в сутки до НЖТ. В этой группе пациентов определенно не прослеживается склонность к гендерной акцентуации.
Дебют аритмии обычно происходит в возрасте до 35 лет [401].
Фасцикулярная левожелудочковая тахикардия
В группе ФТ преобладают пациенты мужского пола, дебют заболевания обычно приходится на возраст до 25 лет.
Клиническими проявлениями данного варианта аритмии являются стабильные приступы устойчивой ЖТ, как правило, протекающие с минимальной гемодинамической значимостью, легко купирующиеся внутривенным введением изоптина. У большинства пациентов в межприступном периоде наблюдается отсутствие эктопической желудочковой активности. Генетические детерминанты ФТ не изучены. При отсутствии лечения и непрерывно-рецидивирующей форме течения ЖТ описаны случаи исхода в аритмогенную кардиопатию, с хорошим восстановлением размеров и ФВ ЛЖ при устранении ЖТ [4].
Стратификация риска
В таблицах VII.13.1–VII.13.5 представлен алгоритм стратификации риска ВСС у пациентов с ЖА струтурно нормального сердца.
Обилие признаков, включенных в анализ, обусловлено сложностью выявления и неочевидностью риска ВСС у пациентов со структурно нормальным миокардом. Кроме того, ЖА структурно нормального сердца во многом могут быть обусловлены ещё не изученной генетически детерминированной патологией, фенотипическими проявлениями которой могут быть так называемые “неспецифические” изменения на ЭКГ транзиторного характера. При идиопатических ЖА следует быть настороженным в отношении ранних стадий АДПЖ и аритмогенного варианта латентного миокардита; дифференциальный диагноз между этими двумя нозологическими формами бывает крайне затруднительным без проведения генетического исследования.
Таблица VII.13. 1
Клинические данные
| 1. Эпизод ВСС в анамнезе | |
| Да | Нет |
| Обсуждать имплантацию ИКД | См. пункт 2 |
| 2. Головокружения, синкопальные состояния на фоне ЖТ | |
| Да | Нет |
| Обсуждать возможность ЭФИ, РЧА | См. пункт 3 |
| 3. Одышка при физических нагрузках на фоне ЖА | |
| Да | Нет |
| Обсуждать ААТ или ЭФИ и РЧА | См. пункт 4 |
| 4. Индукция ЖТ или увеличение количества ЖЭС на фоне физической нагрузки или в восстановительном периоде | |
| Да | Нет |
| ААТ β-блокаторами/ соталолом; Обсуждать возможность ЭФИ, РЧА | См. пункт 5 |
| 5. Эффект от проводимой антиаритмической терапии | |
| Да | Нет |
| Динамическое наблюдение кардиологом | См. рекомендации |
Таблица VII.13.2
Анамнестические (в т.ч. семейные) данные
| 1. Синкопальные состояния неизвестной этиологии в анамнезе | ||
| Да | Нет | |
| Обсуждать проведение ЭФИ | См. пункт 2 | |
| 2. Синкопальные состояния у родственников | ||
| Да | Нет | |
| Генетическая консультация, кардиологический скрининг кровных родственников, в т.ч. детей | См. пункт 3 | |
| 3. Данные о наличии желудочковой аритмии у родственников | ||
| Да | Нет | |
| Генетическая консультация, кардиологический скрининг кровных родственников, в т.ч. детей | См. пункт 4 | |
| 4. Реализация проаритмических и/или аритмогенных эффектов лекарственных препаратов | ||
| Коррекция ААТ, обсуждать ЭФИ. Генетическая консультация | См. рекомендации | |
| ААТ β-блокаторами/ соталолом; Обсуждать возможность ЭФИ, РЧА | См. пункт 5 | |
Таблица VII.13.3
Данные ЭКГ и холтеровского мониторирования
| 1. Стабильные пароксизмы ЖТ | |
| Да | Нет |
| Обсуждать ЭФИ, РЧА (при неэффективности – ИКД) | См. пункт 4 |
| 2. Длительность цикла ЖТ менее 360 мс | |
| Да | Нет |
| Обсуждать ЭФИ на предмет индукции ФЖ (за исключением ФТ). Если ФЖ не индуцируется – см. п.1 | См. пункт 1 |
| 3. Ширина эктопического комплекса QRS при ЖТ более 160 мс | |
| Да | Нет |
| Обсуждать ЭФИ на предмет индукции полиморфной ЖТ/ФЖ (за исключением ЖТ из проекции правого/некоронарного синусов Вальсальвы аорты из ВТЛЖ) | См. пункт 1 |
| 4. Градация ЖА по Lown IIb и выше | |
| Да | Нет |
| Подбор ААТ, обсуждать ЭФИ, РЧА | См. пункт 5 |
| 5. Выявление поздних потенциалов желудочков | |
| Да | Нет |
| Обсуждать проведение нагрузочных проб, ЭФИ | См. пункт 6 |
| 6. Транзиторное изменение длительности QTc за пределы нормативных значений по данным ХМ | |
| Да | Нет |
| Анализ принимаемых ААП; генетическое консультирование | См. пункт 7 |
| 7. Дисперсия интервала QT более 100 мс | |
| Да | Нет |
| Обсуждать проведение нагрузочных проб, ЭФИ | См. пункт 8 |
| 8. Наличие е-волны на ЭКГ, в т.ч. транзиторной, по данным ХМ | |
| Да | Нет |
| Генетическое консультирование на предмет дебюта АДПЖ | См. пункт 9 |
| 9. Наличие j-волны на ЭКГ, в т.ч. транзиторной, по данным ХМ | |
| Да | Нет |
| Генетическое консультирование | См. пункт 10 |
| 10. Наличие “зазубрин” на R – зубце эктопического QRS | |
| Да | Нет |
| Обсуждать проведение нагрузочных проб, ЭФИ (при аритмии выше IIb градации по Lown) | См. пункт 11 |
| 11. Выявление микровольтной альтернации зубца Т по данным ХМ | |
| Да | Нет |
| Обсуждать проведение нагрузочных проб, ЭФИ | См. пункт 12 |
| 12. Преходящие нарушения проводимости (АВ, ВЖ) | |
| Да | Нет |
| Обсуждать проведение нагрузочных проб, ЭФИ; иммунологическое исследование на латентный миокардит | См. пункт 13 |
| 13. Политопные ЖА градации IIb и выше по Lown | |
| Да | Нет |
| Обсуждать проведение нагрузочных проб, ЭФИ; иммунологическое исследование на латентный миокардит | См. пункт 14 |
| 14. Сочетание предсердных и желудочковых аритмий | |
| Да | Нет |
| Иммунологическое исследование на латентный миокардит | Динамическое наблюдение кардиологом |
Таблица VII.13.4.
Данные инструментальных методов исследования
| 1. МРТ: зоны фиброза/истончения в миокарде желудочков сердца | |
| Да | Нет |
| Диф. диагноз между дебютом АДПЖ и латентным миокардитом | См. пункт 2 |
| 2. МРТ: зоны жировых включений интрамиокардиально | |
| Да | Нет |
| Генетическое исследование для исключения/верификации АДПЖ | См. пункт 3 |
| 3. МРТ: зоны жировых включений эпикардиально | |
| Да | Нет |
| Иммунологическое исследование на латентный миокардит | См. пункт 4 |
| 4. МРТ: накопление контраста интрамиокардиально в раннюю фазу | |
| Да | Нет |
| Иммунологическое исследование на латентный миокардит | См. пункт 5 |
| 5. МТР: накопление контраста интрамиокардиально в отсроченную фазу | |
| Да | Нет |
| Диф. диагноз между дебютом АДПЖ и латентным миокардитом | См. пункт 6 |
| 6. МРТ: расширение ВТПЖ/ ВТЛЖ | |
| Да | Нет |
| Диф. диагноз между дебютом АДПЖ и латентным миокардитом | См. пункт 7 |
| 7. Сцинтиграфия: зоны мозаичной гипоперфузии миокарда ЛЖ | |
| Да | Нет |
| Иммунологическое исследование на латентный миокардит | Динамическое наблюдение кардиологом |
Таблица VII.13.5
Данные эндокардиального ЭФИ
| 1. Индукция ФЖ на фоне стандартизированного протокола стимуляции желудочков | |
| Да | Нет |
| Обсуждать ИКД | См. пункт 2 |
| 2. Индукция полиморфной ЖТ на фоне стандартной программированной стимуляции | |
| Да | Нет |
| Обсуждать ИКД | См. пункт 3 |
| 3. Индукция мономорфной высокочастотной гемодинамически значимой ЖТ на фоне стандартной программированной стимуляции | |
| Да | Нет |
| Обсуждать РЧА/ИКД | Обсуждать РЧА/ААТ |
Рекомендации по профилактике ВСС
Класс I
1. РЧА показана пациентам без структурной патологии сердца с пароксизмальной или непрерывно-рецидивирующей ЖТ из ВТПЖ/ВТЛЖ (основной фактор риска ВСС) при резистентности, непереносимости или отказе от проведения ААТ (В).
2. РЧА показана всем пациентам с левожелудочковой фасцикулярной тахикардией (ФТ) (А).
3. Профилактическая ААТ показана пациентам со структурно нормальным сердцем при определяемой градации аритмии по Lown выше IIb (основной фактор риска ВСС) (C).
4. При выявлении “минимальных изменений” ПЖ/ЛЖ, укладывающихся в рамки аритмогенного варианта латентного миокардита, как причины возникновения ЖА (основной фактор риска ВСС), показано патогенетическое и этиотропное лечение основного заболевания вне зависимости от длительности анамнеза (С).
5. При выявлении “минимальных изменений” ПЖ (реже – ЛЖ), не укладывающихся в рамки латентного миокардита, как причины возникновения ЖА (основной фактор риска ВСС), показано генетическое
тестирование для исключения дебюта АДПЖ.
6. Имплантация ИКД показана пациентам без структурной патологии сердца с ЖА, пережившим ВСС (основной фактор риска ВСС) без провоцирующих обратимых причин. (В).
7. Имплантация ИКД показана пациентам без структурной патологии сердца с устойчивой ЖТ (основной фактор риска ВСС), требующей для купирования медикаментозной или электрической кардиоверсии, при отсутствии эффекта от профилактической ААТ и неэффективности РЧА (С).
Класс IIa
1. РЧА показана пациентам без структурной патологии сердца с устойчивой или непрерывно рецидивирующей ЖТ (основной фактор риска ВСС). РЧА в этих случасях рассматривается как альтернатива ААТ при предпочтении пациентом интервенционного вида лечения (С).
2. Профилактическая ААТ бета-блокаторами или соталолом показана пациентам без структурной патологии сердца при при определяемой градации ЖА по Lown выше IIb (основной фактор риска ВСС), провоцирующейся физической нагрузкой и регистрирующейся при ХМ преимущественно в дневное время (С).
3. Профилактическая ААТ препаратами IC класса показана пациентам без структурной патологии сердца при определяемой градации ЖА по Lown выше IIb (основной фактор риска ВСС), возникающей на
фоне синусовой брадикардии, подавляющейся физической нагрузкой и регистрирующейся при ХМ преимущественно в ночное время (С).
4. Проведение ЭндоЭФИ целесообразно у пациентов с ЖА без структурной патологии сердца с жалобами на сердцебиение, эпизоды головокружения и синкопальные состояния, если в качестве причины их возникновения предполагается ЖТ (основной фактор риска ВСС) (В).
Класс IIb
1. РЧА показана пациентам без структурной патологии сердца с устойчивой мономорфной ЖА из ВТПЖ/ВТЛЖ, при определяемой градации аритмии по Lown выше IIb (основной фактор риска ВСС).
РЧА в этих случаях рассматривается как альтернатива ААТ при предпочтении пациентом интервенционного вида лечения (С).
2. Вспомогательная профилактическая терапия омакором рекомендуется пациентам с ЖА (основной фактор риска ВСС) без структурной патологии сердца (С).
Класс III
1. Профилактическая ААТ не показана пациентам без структурной патологии сердца при определяемой градации ЖА по Lown ниже IIа (С).
2. Профилактическая ААТ не показана пациентам без структурной патологии сердца с дебютом ЖА (длительность аритмического анамнеза не превышает 2 месяцев) (С).
3. РЧА не показана пациентам без структурной патологии сердца с устойчивой мономорфной ЖА из ВТПЖ/ВТЛЖ при определяемой градации аритмии по Lown ниже IIb (С).
4. РЧА не показана пациентам без структурной патологии сердца с дебютом ЖА (длительность аритмического анамнеза не превышает 6 месяцев) (С).
5. РЧА не показана пациентам с выявленными “минимальными изменениями ПЖ/ЛЖ”, укладывающимися в рамки аритмогенного варианта латентного миокардита, до завершения проведения патогенетической и этиотропной терапии основного заболевания.
VII.13.Б. Стратификация риска и профилактика ВСС у пациентов с электролитными нарушениями
Клинически значимые нарушения электролитного баланса могут приводить к жизнеугрожающим нарушениям ритма и проводимости при структурно нормальном миокарде. Наиболее часто встречающиеся в клинической практике ситуации развития электролитных нарушений следующие:
1. Применение мочегонных препаратов (прежде всего тиазидных диуретиков);
2. Интоксикация сердечными гликозидами;
3. Острая и хроническая почечная недостаточность, в т.ч. хронический гемодиализ;
4. Постперфузионные электролитные нарушения, непосредственно связанные с проведением искусственного кровообращения;
5. Массивные гемотрансфузии;
6. Хронические интоксикации: алкогольная/ наркотическая зависимость;
7. Голодание и анорексия.
Причиной ВСС в этих случаях могут быть следующие нарушения:
Гипокалиемия. Применение мочегонных препаратов, осложнение ИК, гемодилюция, гиперинсулинемия, дыхательный и метаболический алкалоз, активация ренин-ангиотензин-альдостероновой системы и проч.
Осложнения: предсердные и желудочковые аритмии.
Гиперкалиемия. Кроме случаев почечной недостаточности, уровень калия в крови может повышаться при метаболическом ацидозе, гемолизе и гемоглобинурии на почве перфузионного повреждения крови, при гемотораксе, массивных гемотрансфузиях, введении калийсодержащих препаратов в больших дозах, например при болюсном быстром введении более 10 млн. ЕД калиевой соли пенициллина и проч.
Осложнения: блокады проведения электрического импульса, остановка сердца в систолу.
Гипомагниемия. Применение диуретиков, переливание больших колическтв цитратной крови, искусственное кровообращение, кардиотоксический эффект адреналина и проч.
Осложнения: при дефиците магния кардиомиоциты в избытке теряют калий, который замещается натрием и водой. Этот процесс ионного дисбаланса существенно усугубляет ишемические повреждения кардиомиоцитов, а иногда и сам по себе предопределяет сердечный арест на фоне ЖТ типа «пируэт».
Гипермагниемия. Острая почечная недостаточность с анурией, избыточное парентеральное введение препаратов магния в организм.
Осложнения: расстройства предсердно-желудочковой проводимости, при концентрации магния в плазме до 2,5–3,0 ммоль×л–1. При концентрации 3,5–4,0 ммоль×л–1 наступает глубокое угнетение центральной нервной системы – так называемый «магнезиальный наркоз».
Гиперкальциемия. Тиазидные диуретики, злокачественные новообразования, препараты лития, феохромоцитома, эндокринная патология.
Осложнения: желудочковые аритмии, нарушения проводимости.
Гипокальциемия. Хронический некомпенсированный алколоз при различных интоксикациях, эндокринная патология, гипоальбуминемия, гипомагниемия и проч.
Осложнения: удлинение интервала QT, ЖТ по типу torsades de pointes
Рекомендации по профилактике ВСС
Класс I
1. Применение препаратов солей калия и магния оправдано при лечении и для профилактики ЖА у пациентов при приеме тиазидных диуретиков (В).
2. Применение препаратов солей калия и магния оправдано при лечении и для профилактики ЖА у пациентов после операций с искусственным кровообращением (КШ и проч.) (В).
Класс IIa
1. У пациентов с верифицированными угрожающими жизни ЖА и структурно нормальным сердцем целесообразно поддерживать уровень калия сыворотки крови в диапазоне 4,5 – 5,5 ммоль/л (C).
2. Применение препаратов солей калия и магния оправдано при лечении и для профилактики ЖА у пациентов при интоксикации сердечными гликозидами (В).
Класс IIb.
1. Применение препаратов солей калия и магния оправдано при лечении и для профилактики ЖА у пациентов со структурно нормальным миокардом при острых и хронических алкогольных и наркотических интоксикациях, анорексии (С).
Класс III
1. Применение препаратов солей калия и магния не показано пациентам с острой и хронической почечной недостаточностью (В).
VII.14. Связь ВСС с физическими факторами и токсичными веществами
VII.14.A. Курение и ВСС
Курение ответственно за 30% всех летальных исходов, связанных с ИБС, однако в плане предупреждения ВСС оно является независимым фактором риска от наличия или отсутствия ИБС как основного заболевания [46, 59, 402]. Активация симпатической нервной системы, вызванная никотином, может снижать вариабельность ритма сердца и повышать вероятность возникновения ЖА и ВСС [403–407].
Прекращение курения значительно снижает риск ВСС.
Рекомендации по стратификации риска и профилактике ВСС
Класс I
1. Курение (пассивное курение) настоятельно не рекомендуется всем пациентам с наличием основных (верифицированные ЖА и/или предотвращенной ВСС) и второстепенных факторов риска ВСС (B).
2. Пристрастие к курению должно выясняться у всех пациентов с таким основным фактором риска ВСС как ЖА, отражаться в медицинской документации, а пациентам необходимо настоятельно рекомендовать программы, способствующие прекращению курения (С).
VII.14.Б. Липиды и ВСС
Статины снижают риск развития ЖА/ВСС у пациентов с ИБС и ишемической кардиопатией, вероятно, за счет антиишемического, а не антиаритмического эффекта. У пациентов с неишемическим генезом кардиопатий назначение статинов не приводит к снижению риска ЖА/ВСС [408].
Несмотря на то, что при ИБС имеется связь между повышенным риском возникновения ЖТ/ВСС и высоким уровнем общего холестерина, липопротеидов очень низкой плотности, липопротеидов низкой плотности, низким уровнем липопротеидов высокой плотности в сочетании с высоким уровнем триглицеридов и аполипопротеина В, эффективность терапии статинами, в плане снижения риска развития ЖА/ВСС, не зависит от динамики липидов [409]. Исследований по оценке влияние снижения уровня липидов на частоту возникновения ВСС в рамках первичной профилактики не проводились. Тем не менее, такое влияние может быть спрогнозировано на основании того, что снижение уровня липидов сопровождается уменьшением относительного риска смерти от ИБС и других причин на 20–40% [49, 410, 411].
Низкий уровень ПНЖК и омега-3 индекс являются независимыми факторами риска смерти от ИБС, особенно после перенесенного сердечного ареста [412, 413]. В нескольких исследованиях было показано, что ПНЖК, преимущественно в экспериментальных моделях, могут снижать частоту ВСС, возможно, за счет предупреждения ЖА [412–415].
Добавление ПНЖК к стандартной терапии может снижать вероятность ВСС у больных ИБС [95, 416]. Вместе с тем, до настоящего времени сохраняются разночтения между экспериментальными и клиническими данными в отношении снижения риска как ЖА, так и ВСС при назначении ПНЖК [417].
Рекомендации по стратификации риска и профилактике ВСС
Класс I
1. Терапия статинами эффективна у пациентов с ИБС для уменьшения риска развития ЖА/ВСС (А).
Класс IIb
1. ПНЖК показаны пациентам с ИБС, имеющим ЖА, в добавлении к стандартной терапии (B).
VII.15. Стратификация риска и профилактика ВСС у отдельных групп населения
VII.15.A. Стратификация риска и профилактика ВСС у спортсменов
По данным итальянских исследователей [418, 419], частота ВСС у спортсменов составляет 2,6 у мужчин и 1,1 у женщин на 100 000 спортсменов в год, что в 2,4 раза выше, чем у лиц сопоставимого возраста, но не занимающихся спортом регулярно. Среди французских спортсменов случаи ВСС регистрируются еще чаще – 6,5 случаев на 100 000 [420].
Данные национального регистра ВСС спортсменов молодого возраста в США свидетельствуют о прогрессивном увеличении ВСС в течение последних 2,5 десятилетий в среднем на 6% в год [421]. В настоящее время в России подобные статистические отчеты отсутствуют.
Наиболее часто ВСС регистрируется у лиц, профессионально занимающихся футболом (от 30% до 40% всех случаев ВСС в спорте в странах Европы и США). С несколько меньшей частотой ВСС выявляется в баскетболе, велогонках и в контактных видах спорта [418, 419].
Прослеживается отчетливая взаимосвязь ВСС в спорте с гендерным признаком – более 90% умерших внезапно спортсменов – мужчины [418, 422].
По данным некоторых исследований, наиболее частой причиной ВСС среди молодых спортсменов является гипертрофическая кардиомиопатия, доля которой может достигать 28–36% случаев [18, 421, 424]. Из других причин ВСС выделяют различные аномалии коронарных сосудов (14–17%), наиболее частым вариантом из которых является отхождение левой коронарной артерии от правого синуса Вальсальвы; миокардиты (около 5%), АДПЖ (около 5%).
Вместе с тем, высказываются сомнения в правомочности постановки диагноза ГКМП во всех случаях обнаружения на секции выраженной гипертрофии ЛЖ [418, 425, 426]. Некоторыми отечественными авторами предлагается термин компенсаторно-гипертрофическая стрессорная кардиомиопатия, основным отличием которой от ГКМП является обратная динамика изменений массы миокарда ЛЖ после прекращения физических нагрузок [424]. При этом очевидно, что наличие ГЛЖ у спортсмена является неблагоприятным прогностическим фактором развития ВСС.
Прогнозирование ВСС в спорте является чрезвычайно трудной задачей, поскольку около 80% лиц, умерших внезапно, не предъявляли каких-либо жалоб накануне смерти, а в анамнезе у них отсутствовали указания на ВСС у родственников [418]. Тем не менее, в некоторых странах Европы и США предложено несколько протоколов для профилактики ВСС у спортсменов, включающих в себя данные сбора жалоб, анамнеза, в том числе семейного, физикального обследования, а также в некоторых странах – инструментальных исследований, включая ЭКГ и/или Эхо-КГ. В Италии введение такого протокола позволило снизить частоту ВСС у спортсменов с 1980-х по 2000-е годы в 3,5–5 раз [427, 428].
В 2011 г. В России опубликованы первые Национальные рекомендации по допуску спортсменов с отклонениями со стороны сердечнососудистой системы к тренировочно-соревновательному процессу [355].
В них предлагается двухэтапный алгоритм скрининга спортсмена с целью решения вопроса о допуске к занятиям спортом: 1) анализ данных анамнеза, осмотра и регистрация поверхностной ЭКГ в 12 отведениях; 2) углубленное медицинское обследование (при отягощенном семейном анамнезе, симптомах, патологии при осмотре или изменениях на ЭКГ, не связанных с тренировочным процессом).
Отдельного внимания заслуживает вопрос о принятии решения по допуску к занятиям спортом в случае выявления той или иной патологии сердечно-сосудистой системы. Данный раздел выходит за рамки настоящего документа, он подробно рассмотрен в Национальных рекомендациях по допуску спортсменов с отклонениями со стороны сердечно-сосудистой системы к тренировочно-соревновательному процессу [355].
Рекомендации по стратификации риска и профилактике ВСС
Класс I
1. При клинической оценке спортсменов следует проводить тщательный сбор анамнеза (включая семейный анамнез преждевременной смерти или ВСС), физикальный осмотр и регистрацию ЭКГ в 12 отведениях (C).
2. При выявлении у спортсмена сердечно-сосудистых заболеваний следует решить вопрос о возможности продолжения занятиями спортом, характере и степени физической нагрузки (C).
Класс IIa
1. При выявлении отягощенного семейного анамнеза, симптомов, патологии при осмотре или изменениях на ЭКГ, не связанных с тренировочным процессом, следует провести углубленное медицинское обследование, включающее ЭхоКГ, и при необходимости, ряд других специфических тестов (стресс-тест, МРТ, длительное мониторирование ЭКГ, эндоЭФИ и др.) (С).
VII.15.Б. Стратификация риска и профилактика ВСС у родственников пациентов, погибших от ВСС
Рекомендации по стратификации риска и профилактике ВСС
Класс I
1. Генетическое тестирование рекомендуется всем пациентам с семейным анамнезом ВСС (синдромы LQT, SQT, КПЖТ, Бругада и т.д.) (В).
2. Тщательное инструментальное обследование (ЭКГ, ЭХО-КГ, лабораторные тесты и др.) рекомендуется всем пациентам с семейным анамнезом ВСС (С).
Оценка возможных факторов риска рекомендуется всем пациентам с семейным анамнезом внезапной смерти с целью выявления лиц с высоким риском ВСС [429]. Вместе с тем, для каждого заболевания (ГКМП, синдром удлиненного интервала QT, синдром Бругада и другие) существуют отдельные целевые факторы стратификации риска [429–432].
Проведение генетического тестирования целесообразно у пациентов с семейным анамнезом ВСС [432].
VII.15.В. Стратификация риса и профилактика ВСС у пожилых пациентов
Частота ВСС развития увеличивается с возрастом [429, 430]. ЖА являются нередким клиническим симптомом у пожилых людей, особенно при наличии структурной патологии сердца [433–435]. ЖА могут являться предвестниками дестабилизации ИБС и ВСС [436, 438].
Профилактика ВСС у пациентов пожилого возраста с ЖА принципиально не отличается от рекомендованных выше подходов. Для лечения ЖА у пожилых лиц, особенно с ИБС, рекомендуется использовать бета-блокаторы, при отсутствии противопоказаний к их приему. Однако, несмотря на доказанную эффективность в отношении снижения смертности от всех причин и ВСС, изолированное их применение может быть недостаточным у пожилых людей. При лечении жизнеугрожающих ЖА предпочтительной является комбинация бета-блокаторов с амиодароном или монотерапия амиодароном, в случае непереносимости бета-блокаторов [29, 437].
Несколько рандомизированных проспективных исследований продемонстрировали эффективность ИКД в отношении первичной и вторичной профилактики ВСС у пациентов, страдающих ИБС, по сравнению с ААТ во всех возрастных группах [25–27, 31–34]. Все эти исследования включали значительное число пациентов в возрасте старше 65 лет. Ряд экспериментальных исследований свидетельствует о том, что инвазивные методы лечения пациентов с угрожающими жизни ЖА одинаково эффективны как в пожилом, так и в молодом возрасте [439–441]. Пациенты старческого возраста, имеющие множественную сопутствующую патологию и ограниченную прогнозируемую продолжительность жизни, могут не подходить в качестве кандидатов для ИКД-терапии, даже если они удовлетворяют критериям для ее проведения.
Рекомендации по стратификации риска и профилактике ВСС
Класс I
1. Пожилые пациенты с ЖА должны лечиться, как правило, так же, как и больные молодого возраста. Это подразумевает, что стратификация риска и профилактика ВСС у пожилых пациентов осуществляется на основании выявления основных и второстепенных факторов риска.
Проведение профилактики ВСС включает в том числе, имплантацию ИКД и ЭКС пациентам, которые получают длительную оптимальную лекарственную терапию, с хорошим функциональным статусом* и благоприятным прогнозом выживаемости в течение года и более (C) 2. Дозировки и подбор доз ААП должны быть скорректированы с учетом измененной фармакокинетики у пожилых пациентов (C).
Класс III
1. Проведение ИКД-терапии у пациентов с прогнозируемой продолжительностью жизни менее года вследствие основных и сопутствующих
заболеваний нецелесообразно (C).
2. ААП I класса не должны назначаться пожилым пациентам с органическими заболеваниями сердца (А).
– о методиках проведения оценки функционального статуса вы можете прочитать на сайте http://www.chcr.brown.edu/pcoc/functi.htm
VIII. ЗАКЛЮЧЕНИЕ
В России продолжается оставаться актуальной проблема смертности от сердечно-сосудистых заболеваний. При этом на долю внезапной сердечной смерти приходится около половины всех летальных исходов. Реализация сценария ВСС происходит в результате развития острой левожелудочковой недостаточности на фоне злокачественных желудочковых аритмий, манифестация которых, сопровождается нарушениями как системной, так и регионарной гемодинамики, прежде всего со стороны ЦНС. Следствием чего является вероятное возникновение необратимых изменений со стороны жизненноважных органов и развитие летального исхода. Наличие или отсутствие предсуществующей структурной патологии сердца может иметь определяющее значение для адаптационных изменений параметров сердечного выброса, а значит для характера клинического течения аритмии. В этой связи ключевым значением для клинической интерпретации злокачественного течения любой аритмии, определения ее жизнеугрожающего характера следует считать: обморок, предобморок, головокружение, гипотензию, прогрессию проявлений сердечной недостаточности, стенокардию.
Использование современных медицинских технологий, заключающихся в имплантации кардиовертеров-дефибрилляторов, позволяет эффективно проводить профилактику внезапной сердечной смерти. В последние годы в рамках государственного проекта «Здоровье» в различных регионах нашей страны было открыто несколько федеральных кардиохирургических центров. Тем не менее, количество проведенных имплантаций кардиовертеров-дефибрилляторов не удовлетворяет средним потребностям из расчета на 1 млн. жителей страны и значительно ниже таковых показателей по сравнению с ведущими европейскими странами и США.
Главной причиной данного положения дел является не столько недостаточное финансирование данного раздела, сколько, прежде всего, отсутствие системного подхода к адекватной клинической оценке больных с заболеваниями сердечно-сосудистой системы; разное «понимание» больного врачами кардиологами, терапевтами, интервенционистами, кардиохирургами; посредственным уровнем остдипломного образования по данной проблематике, а также отсутствием аудита качества, оказываемой медицинской помощи, направленной на предотвращение ВСС.
Настоящие Рекомендации являются одним из этапов создания и реализации в кратчайшие сроки эффективной программы профилактики внезапной сердечной смерти в нашей стране. Рабочий вариант решения проблемы профилактики ВСС представлен в приложении к настоящим рекомендациям.
Список литературы
1. Бойцов С.А., Никулина Н.Н., Якушин С.С. и др. Внезапная сердечная смерть у больных ИБС: распространенность, выявляемость и проблемы статистического учета. Российский кардиологический журнал 2011; 2:59–64.
2. Центральная база статистических данных Федеральной службы государственной статистики, 2010 год (www.gks.ru/dbscripts/Cbsd).
3. Zipes DP, Wellens HJJ. Sudden cardiac death. Circulation 1998; 98:2334–2351.
4. Zipes DP, Camm AJ, Borggrefe M et al. ACC/AHA/ESC 2006 Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death–Executive Summary: A Report of the American College of Cardiology/American Heart Association Task Force and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for Management of Patients With Ventricular Arrhythmias and the Prevention of Sudden Cardiac Death). J Am Coll Cardiol 2006; 48:1064–1108.
5. Priori SG, Aliot E, Blшmstrom-Lundqvist C et al. Task Force on Sudden Cardiac Death, European Society of Cardiology. Summary of recommendations. Eur Heart J 2001; 22:1374–450.
6. Bayes de Luna A, Coumel P, Leclercq JF. Ambulatory sudden cardiac death: mechanisms of production of fatal arrhythmia on the basis of data from 157 cases. Am Heart J 1989; 117:151–159.
7. Leclercq JF, Coumel P, Maison-Blanche P et al. [Mechanisms determining sudden death. A cooperative study of 69 cases recorded using the Holter method]. Arch Mal Coeur Vaiss. 1986; 79(7):1024–33.
8. Panidis IP, Morganroth J. Sudden death in hospitalized patients: cardiac rhythm disturbances detected by ambulatory electrocardiographic monitoring. J Am Coll Cardiol. 1983; 2(5):798–805.
9. Mehta D, Curwin J, Gomes JA, Fuster V. Sudden death in coronary artery disease: acute ischemia versus myocardial substrate. Circulation 1997; 96:3215–3223.
10. Roger VL, Go A, Lloyd-Jones DM et al. on behalf of the American Heart Association Statistics Committee and Stroke Statistics Subcommittee. Heart Disease and Stroke Statistics–2012 Update: A Report From the American Heart Association Circulation 2012; 125:e2–e220.
11. Gillum RF. Sudden death in the United States: 1980–1985. Circulation 1989; 79:756–765.
12. Бокерия Л.А., Ревишвили А.Ш., Неминущий Н.М. Внезапная сердечная смерть. – М.: ГЭОТАР-медиа, 2011. – 272 с.
13. Мазур Н.А. Популяционные исследования и их значение в изучении эффективности первичной и вторичной профилактики ишемической болезни сердца среди населения. Кардиология. 1977; 17 (8):5–9.
14. Мазур Н.А., Никитин Ю.П., Гафаров В.В. Результаты двухлетнего эпидемиологического изучения инфаркта миокарда в Новосибирске. Тер. архив. 1981; 8:10–3.
15. Банщиков Г.Т., Т.Н. Зиновенко, Г.Я. Гудков. Внезапная добольничная смерть от острой коронарной недостаточности и инфаркта миокарда (по данным регистра острого инфаркта миокарда в Вологде). Кардиология 1985; 4: 103–4.
16. Якушин С.С., Бойцов С.А., Фурменко Г.И., и др. Внезапная сердечная смерть у больных ишемической болезнью сердца по результатам Российского многоцентрового эпидемиологического исследования Заболеваемости, смертности, качества диагностики и лечения острых форм ИБС (РЕЗОНАНС). Российский
кардиологический журнал. 2011; 2: 59–64.
17. Солохин Ю.А., Макаров Л.М., Комолятова В.Н. Внезапная внегоспитальная сердечная смерть в молодом возрасте (анализ за 5 лет по данным 2-го танатологического отделения бюро Судебно-медицинской экспертизы Департамента Здравоохранения г. Москвы) “Медицинская экспертиза и право” (2012 г., в печати).
18. Внезапная сердечная смерть. Рекомендации Европейского кардиологического общества (ред. проф. Н.А. Мазур). – М: МЕДПРАКТИКА-М, – 2003. – 148 с.
19. Myerburg R.J., Kessler K.M., Castellanos A. Sudden cardiac death. Structure, function, and time-dependence of risk.Circulation 1992; 85: 12–20.
20. Vreede-Swagemakers J.J., Gorgels A.P., Dubois-Arbouw W.I. et al. Out-of-hospital cardiac arrest in the 1990’s: a population-based study in the Maastricht area on incidence, characteristics and survival. J Am Coll Cardiol 1997; 30: 1500–5.
21. Sans S., Kesteloot H., Kromhout D. The burden of cardiovascular diseases mortality in Europe. Task force of the European society of cardiology on cardiovascular mortality and morbidity statistics in Europe. Eur Heart J 1997; 18: 1231–48.
22. Myerburg R.J. Sudden cardiac death: exploring the limits of our knowledge. J Cardiovasc Electrophysiol 2001; 12: 369–81.
23. Zheng Z.J., Croft J.B., Giles W.H. et al. Sudden cardiac death in the United States, 1989 to 1998. Circulation 2001; 104: 2158–63.
24. Bigger JT Jr. Identification of patients at high risk for sudden cardiac death. Am J Cardiol. 1984; 54(9):3D–8D.
25. A comparison of antiarrhythmic-drug therapy with implantable defibrillators in patients resuscitated from near-fatal ventricular arrhythmias. The Antiarrhythmics versus Implantable Defibrillators (AVID) Investigators. N Engl J Med 1997; 337(22):1576–83.
26. Connolly S., Gent M., Roberts R. et al. Canadian Implantable Defibrillator Study (CIDS): A randomized trial of the implantable defibrillator against amiodarone. Circulation 2000; 101(11):1297–302.
27. Kuck KH, Cappato R, Siebels J, Ruppel R. Randomized comparison of antiarrhythmic drug therapy with implantable defibrillators in patients resuscitated from cardiac arrest. Circulation 2000; 102:748–754.
28. Camm AJ, Julian D, Janse G et al. The European Myocardial Infarct Amiodarone Trial (EMIAT). EMIAT Investigators. Am J Cardiol 1993; 72(16):95F–98F.
29. Cairns JA, Connolly SJ, Roberts R, Gent M. Canadian Amiodarone Myocardial Infarction Arrhythmia Trial (CAMIAT): rationale and protocol. CAMIAT Investigators. Am J Cardiol. 1993; 72(16):87F–94F.
30. Olesen RM, Thomsen PE, Saermark K, Glikson M et al. Statistical analysis of the DIAMOND MI study by the multipole method. J Physiol Meas 2005; 26(5):591–8.
31. Moss AJ, Hall WJ, Cannom DS et al. Improved survival with an implanted defibrillator in patients with coronary disease at high risk for ventricular arrhythmia. Multicenter Automatic Defibrillator Implantation Trial Investigators. N Engl J Med, 1996; 335:1933–1940.
126 Список литературы Список литературы 127
32. Moss AJ, Zareba W, Hall WJ et al. Multicenter Automatic Defibrillator Implantation Trial II Investigators. Prophylactic implantation of a defibrillator in patients with
myocardial infarction and reduced ejection fraction. N Engl J Med, 2002; 346:877–883.
33. Buxton AE, Lee KL, Fisher JD et al. A randomized study of the prevention of sudden death in patients with coronary artery disease. Multicenter Unsustained Tachycardia
Trial Investigators.N Engl J Med, 1999; 341: 1882–1890.
34. Bardy GH, Lee KL, Mark DB et al. Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT) Investigators. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med, 2005; 352: 225–237.
35. Soteriades ES, Evans JC, Larson MG et al. Incidence and prognosis of syncope. NEngl J Med 2002; 347:878–885.
36. Colman N, Nahm K, Ganzeboom KS et al. Epidemiology of reflex syncope. Clin Auton Res 2004; 14 (Suppl 1):i9–i17.
37. Milstein S, Buetikofer J, Lesser J et al. Cardiac asystole: a manifestation of neutrally mediated hypotension bradycardia. J Am Coll Cardiol 1989; 14:1626–1632.
38. Almquist A, Gornick CC, Benson DW et al. Carotid sinus hypersensitivity: evaluation of the vasodepressor component. Ciculation 1985; 67:927–936.
39. Ungar A, Del Rosso A, Giada F et al. Earle and late outcome of treated patients referred for syncope to emergency department: the EGSYS 2 follow-up study. EurHeart J 2010; 32:2021–2026.
40. Weijenberg MP, Feskens EJ, Kromhout D. Blood pressure and isolated systolic hypertension and the risk of coronary heart disease and mortality in elderly men (the Zutphen Elderly Study). J Hypertens 1996; 14:1159–66.
41. Kannel WB. Left ventricular hypertrophy as a risk factor: the Framingham experience. J Hypertens Suppl 1991; 9:S3–S8.
42. Haider AW, Larson MG, Benjamin EJ, Levy D. Increased left ventricular mass and hypertrophy are associated with increased risk for sudden death. J Am Coll Cardiol
1998; 32:1454–9.
43. Staessen JA, Wang JG, Thijs L, Fagard R. Overview of the outcome trials in older patients with isolated systolic hypertension. J Hum Hypertens 1999; 13:859–63.
44. Collins R, Peto R, Mac Mahon S et al. Blood pressure, stroke, and coronary heart disease. Part2, Short-term reductions in blood pressure: overview of randomized drug
trials in their epidemiological context. Lancet 1990; 335:827–38.
45. Cupples LA, Gagnon DR, Kannel WB. Long- and short-term risk of sudden coronary death. Circulation 1992; 85:I11–I18.
46. Wannamethee G, Shaper AG, Macfarlane PW, Walker M. Risk factors for sudden cardiac death in middle-aged British men. Circulation 1995; 91:1749–56.
47. Sexton PT, Walsh J, Jamrozik K, Parsons R. Risk factors for sudden unexpected cardiac death in Tasmanianmen. Aust N Z J Med 1997; 27:45–50.
48. Shepherd J, Cobbe SM, FordI et al. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia.West of Scotland Coronary Prevention Study Group. N Engl J Med 1995; 333:1301–7.
49. Downs JR, Clearfield M, Weis S et al. Primary prevention of acute coronary events with lovastatin in men and women with average cholesterol levels: results of AFCAPS/TexCAPS. Air Force/Texas Coronary Atherosclerosis Prevention Study. JAMA 1998; 279:1615–22.
50. National Cholesterol Education Program. Second Report of the Expert Panelon Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel II). Circulation 1994; 89:1333–445.
51. Albert CM, Hennekens CH, O’Donnell CJ et al. Fish consumption and risk of sudden cardiac death. JAMA 1998; 279:23–8.
52. Burke AP, Farb A, MalcomGT et al. Plaque rupture and sudden death related to exertionin men with coronary artery disease. JAMA 1999; 281:921–6.
53. Lemaitre RN, Siscovick DS, Raghunathan TE et al. Leisure-time physical activity and the risk of primary cardiac arrest. Arch Intern Med 1999; 159:686–90.
54. Aberg H, Lithell H, Selinus I, Hedstrand H. Alcohol in temperance and social disability as risk factors for different causes of death. Acta Med Scand 1986; 220:351–9.
55. Day CP, James OF, Butler TJ, Campbell RW. QT prolongation and sudden cardiac death in patients with alcoholic liver disease. Lancet 1993; 341:1423–8.
56. Vreede-Swagemakers JJ, Gorgels AP, Weijenberg MP et al. Risk indicators for outofhospital cardiac arrest in patients with coronary artery disease. J Clin Epidemiol 1999; 52:601–7.
57. Dekker JM, Schouten EG, Klootwijk P et al Heart rate variability from short electrocardiographic recordings predicts mortality from all causes in middle-aged and elderly men. The Zutphen Study. Am J Epidemiol 1997; 145:899–908.
58. Kannel WB, SchatzkinA. Sudden death: lessons from subsets in population studies. J Am Coll Cardiol 1985; 5:141B–149B.
59. Escobedo LG, Caspersen CJ. Risk factors for sudden coronary death in the United States. Epidemiology 1997; 8:175–80.
60. Hallstrom AP, Cobb LA, Ray R. Smoking as a risk factor for recurrence of sudden cardiac arrest. N Engl J Med 1986; 314:271–5.
61. Curb JD, Rodriguez BL, Burchfiel CM et al. Sudden death, impaired glucose tolerance , and diabetesin Japanese American men. Circulation 1995; 91:2591–5.
62. Suhonen O, Reunanen A, Knekt P, Aromaa A. Risk factors for sudden and non-sudden coronary death. Acta Med Scand 1988; 223:19–25.
63. De Bacquer D, De Backer G, Kornitzer M et al. Prognostic value of ischemic electrocardiographic findings for cardiovascular mortality in men and women. J Am Coll Cardiol 1998; 32:680–5.
64. Kors JA, de Bruyne MC, Hoes A et al. T-loop morphology as a marker of cardiac events in the elderly. J Electrocardiol 1998; 31(Suppl):54–9.
65. Burton F, Cobbe SM. Dispersion of ventricular repolarization and refractoriness. Cardiovas Res 2001; 50:10–23.
66. Dekker JM, Schouten EG, Klootwijk P et al. Association between QT interval and coronary heart disease in middle-aged and elderly men. The Zutphen Study. Circulation1994; 90:779–85.
67. deBruyne MC, Hoes AW, Kors JA et al. QTc dispersion predicts cardiac mortality in the elderly: the Rotterdam Study. Circulation 1998; 97:467–72.
68. Manttari M, Oikarinen L, ManninenV, Viitasalo M. QT dispersion as a risk factor for sudden cardiac death and fatal myocardial infarction in a coronary risk population. Heart 1997; 78:268–72.
69. Fogoros R. Electrophysiologic Testing 4-th edition Wiley-Blackwell, p. 304.
70. Клинические рекомендации ВНОА по проведению клинических электрофизиологических исследований, катетерной (радиочастотной) абляции и имплантации кардиостимуляторов, кардиовертеров-дефибрилляторов у больных с нарушениями ритма сердца (2011 г.). «Золотой абрикос», 518 с.
71. Dargie HJ. Effect CAPRICORN Investigators. Effect of carvedilol on outcome after myocardial infarction in patients with left ventricular dysfunction: the CAPRICORN
randomized trial. Lancet 2001; 357: 1385–1390.
72. Chadda K., Goldstein S., Byington R. et al. Effect of propranolol after acute myocardial infarction in patients with congestive heart failure. Circulation 1986; 73: 503–510.
73. Goldstein S., Fagerberg B., Hjalmarson A. et al. For the MERIT-HF Study Group. Metoprolol- controlled release/extended release in patient with severe heart failure. J. Am. Coll. Cardiol. 2001, 38: 932–938.
74. Lechat Ph. The cardiac Insufficiency Bisoprolol Study – II (CIBIS-II): a randomised trial. Lancet 1999; 353: 9–13.
75. Boutitie F. et al. Amiodarone Interaction With β-Blockers. Analysis of the Merged EMIAT and CAMIAT Databases. Circulation 1999; 99:2268–2275.
76. Lуpez-Sendуn J, Swedberg K, McMurray J et al. Expert consensus document on betaadrenergic receptor blockers. Task Force On Beta-Blockers of the European Society of Cardiology. Eur Heart J 2004; 25(15):1341–62.
77. Yusuf S, Sleight P, Pogue J et al. Effects of an Angiotensin-Converting Enzyme Inhibitor, Ramipril, on Cardiovascular Events in High-Risk Patient. N Engl J Med 2000; 342: 145–153.
78. Hertzel C.G. et al. Effects of ramipril on cardiovascular and microvascular outcomes in people with diabetes mellitus: result of HOPE study and MICRO-HOPE substudy. Heart Outcomes Prevention Evaluation Study Investigators. Lancet 2000; 355: 253–259.
79. Fox K.M. et al. Efficacy of perindopril in reduction of cardiovascular events among patients with stable coronary artery disease: randomised, double – blind, placebocontrolled, multicenter trial (the EUROPA study). Lancet 2003; 362: 782–788.
80. Domanski M.J., Exner D.V., Borkowf C.B. et al. Effect of Angiotensin-Converting Enzyme Inhibition on Sudden Cardiac Death in Patients Following Acute Myocardial Infarction. A Meta-Analysis of Randomized Clinical Trials. J Am Coll Cardiol 1999; 33:598–604.
81. Pfeffer M. A. Braunwald E., Moye L. A. Effect of captopril on mortality and morbidity in patients with left ventricular dysfunction after myocardial infarction. Result of the survival and ventricular enlargement trial. The SAVE Investigators. N Engl J Med 1992; 10:669–677.
82. Kober L., Torp-Pedersen C., Carlsen J. E. et al. For the Trandolapril Cardiac Evaluation (TRACE) Study Group. A clinical trial of the angiotensin-convertingenzyme inhibitor trandolapril in patients with left ventricular dysfunction after myocardial infarction. N. Engl. J. Med. 1995; 333:1670–1676.
83. Solomon S. D., Wang D., Finn P. et al. Effect of Candesartan on Cause-Specific Mortality in Heart Failure Patients : The Candesartan in Heart failure Assessment of Reduction in Mortality and morbidity (CHARM) program. Circulation 2004; 110:2180–2183.
84. Pitt B, Zannad F, Remme WJ et al. Effectivnes of spironolactone added to an angiotensinconverting enzyme inhibitor and loop diuretic for severe chronic congestive heart failure. Am J Cardiol 1996; 78: 902–907.
85. Pitt B., Remme W., Zannad F. et. Al. Eplerenone, a selective aldosterone blocker, in patients with left ventricular dysfunction after myocardial infarction. N Engl J Med 2003; 384: 1309–1321.
86. Pitt B., Zannad F., Remme W., et. Al. For the Randomized Aldactone Evaluation Study Investigators. The effect of spironolactone on morbidity and mortality in patients with severe heart failure. N Engl J Med 1999; 341:709–717.
87. Мареев В.Ю., Агеев Ф.Т., Арутюнов Г.П., и др. Национальные рекомендации ВНОК и ОССН по диагностике и лечению хронической сердечной недостаточности (третий пересмотр) 2009.
88. Nicklas J.M., Pitt B., Timmis G. et. al. Effect of enalapril on survival in patients with reduced left ventricular ejection fractions and congestive heart failure. The SOLVD Investigators. N Engl J Med 1999; 325(5):293–302.
89. Cholesterol Treatment Trialist Collaboratoz-Efficacy and Safety of Cholesterol – lowering Treatment: Prospective Meta-Analysis of Data 9056 Participants in 14 Randomised Trials of Statins. Lancet 2005; 366:1267–1277.
90. Руководство по нарушениям ритма сердца / под ред. Е.И. Чазова, С.П. Голицына. – М.: ГЭОТАР-Медиа, 2010. – 416 с.
91. Арболишвили Г.Н., Мареев В.Ю. Возможности применения омега-3 полиненасыщенных жирных кислот для первичной профилактики у больных сердечной недостаточностью ишемической этиологии. Cердечная недостаточность 2008; 2:73–78.
92. Громова О.А., Торшин И.Ю., Калачева А.Г., Грачева О.Н. Мировой опыт омега3 ПНЖК. Крупномасштабные клинические исследования омега-3 ПНЖК: об эффективности, доказательности и перспективах. Сердце 2011; 5: 263–272.
93. Marchioli R., Barzi F., Bomba E. et al. Early Protection against Sudden Death by n-3 Polyunsaturated Fatty Acids after Myocardial Infarction: Time-Course Analysis of the Result of the Gruppo Italiano per lo Studio della Sopravvivenza nell’Infarto miocardico (GISSI) Prevenzione. Circulation 2002; 105: 1897–1903.
94. Tavazzi L, Maggioni AP, Marchioli R et al. Effect of n-3 polyunsaturated fatty acids in patients with chronic heart failure (the GISSI-HF trial): a randomised, double-blind, placebo-controlled trial. Lancet 2008; 372:1223–30.
95. Нифонтов Е.М., Шихалиев Д.Р., Богачев М.И. и др. Антиаритмическая эффективность омега-3 полиненасыщенных жирных кислот у больных стабильной ишемической болезнью сердца с желудочковыми нарушениями ритма. Кардиология 2010; 12:15–17.
96. Мазур Н.А. Омега-3 полиненасыщенные жирные кислоты: доказательства пользы и перспективы их применения. Кардиология 2012; 4: 80–84.
97. Царегородцев Д.А., Гавва Е.М., Сулимов В.А. Омега-3-полиненасыщенные жирные кислоты в лечении заболеваний сердечно-сосудистой системы. Кардиология 2010; 8:56–62.
98. Шляхто Е. В., Новикова, И. В., Рудаков, М. М., Трешкур, Т. В. Желудочковые аритмии у больных ишемической болезнью сердца: современные концепции этиопатогенеза, диагностики и лечения. Вест. аритмологии 2002; 30: 72–75.
99. Cardiac Arrhythmia Suppression Trial (CAST) Investigators. Preliminary report: effect of encainide and flecainide on mortality in a randomized trial of arrhythmia suppression after myocardial infarction. N Engl J Med. 1989; 321:406–412.
100. The Cardiac Arrhythmia Suppression Trial-II Investigators. Effect of antiarrhythmic agent moricizine on survival after myocardial infarction: the Cardiac Arrhythmia Suppression Trial-II. N Engl J Med. 1992; 327:227–233.
101. Гиляров М.Ю., Сулимов В.А. Амиодарон: прошлое, настоящее и будущее. Клиническая фармакология и терапия 2006; 4: 60–65.
102. Аmiodarone Trials Meta-Analysis Investigators. Effect of prophylactic amiodarone on mortality after acute myocardial and in congestive heart failure: meta-analysis of individual data from 6500 patients in randomised trials. Lancet 1997; 350:1417– 1424.
103. Gruberg L. et al. SCD-HeFT: Sudden Cardiac Death in Heart Failure Trial. Medscape Cardiology 2004; 16.
104. Rossenbacker T., Priori S.G., Zipes D.P. The fight against sudden cardiac death: consensus guidelines as a reference. Eur. Heart J. Suppl., Dec. 2007; 9: I50–I58.
105. Al-Khatib S.M., Sanders G.D., Cicik A. et al. Preventing tomorrow’s sudden cardiac death today: dissemination of effective therapies for sudden cardiac death prevention. Am H Jour 2008; 156:613–22.
106. Aziz EF, Javed F, Pratap B, Herzog E. Strategies for the prevention and treatment of sudden cardiac death. Open Access Emerg Med. 2010; 2: 99–114.
107. Christine M. Albert. Prediction of Sudden Cardiac Death in Patients With Coronary Heart Disease: The Challenge Ahead. Circ Cardiovasc Imaging 2008; 1:175–177.
108. Mark Estes N,A. et al. The Challenge of Predicting and Preventing Sudden Cardiac Death Immediately After Myocardial Infarction. Circulation 2009; 120:185–187.
109. Бокерия Л.А., Бокерия О.Л., Киртбая Л.Н. Сердечная недостаточность и внезапная сердечная смерть. Анналы аритмологии. 2009, 4: 7–20.
110. Ардашев А.В., Джанджгава А.О., Желяков Е.Г. Постоянная электрокардиостимуляция и дефибрилляция в клинической практике. М.: МЕДПРАКТИКА-М, 2007, 224 с.
111. Spotnitz HM, Herre JM, Raza ST et al. Effect of implantable cardioverter-defibrillator implantation on surgical morbidity in the CABG Patch Trial. Surgical Investigators of the Coronary Artery Bypass Graft Patch Trial. Circulation. 1998; 98(19 Suppl):II77–80.
112. Bдnsch D, Antz M, Boczor S et al. Primary prevention of sudden cardiac death in idiopathic dilated cardiomyopathy: the Cardiomyopathy Trial (CAT). Circulation. 2002; 105(12):1453–8.
113. Strickberger SA, Hummel JD, Bartlett TG et al. Amiodarone versus implantable cardioverter-defibrillator:randomized trial in patients with nonischemic dilated cardiomyopathy and asymptomatic nonsustained ventricular tachycardia-AMIOVIRT. J Am Coll Cardiol. 2003; 41(10):1707–12.
114. Kadish A, Quigg R, Schaechter A, Anderson et al. Defibrillators in nonischemic cardiomyopathy treatment evaluation. Pacing Clin Electrophysiol. 2000 Mar; 23(3):338–43.
115. Hohnloser SH, Kuck KH, Dorian P et al, Prophylactic use of an implantable cardioverterdefibrillator after acute myocardial infarction. DINAMIT Investigators. N Engl J Med. 2004; 351(24):2481–8.
116. Ligang Ding et al. The long-term effectiveness of cardiac resynchronization therapy with or without an implantable cardioverter-defibrillator. Eur Heart J 2007; 28(1):42–51.
117. Cappato R, Smith WM, Hood MA, Crozier IG, Jordaens L, Spitzer SG, Ardashev AV, Boersma L, Lupo P, Grace AA, Bardy GH. Subcutaneous chronic implantable defibrillation systems in humans. J Interv Card Electrophysiol. 2012.
118. Bardy GH, Lee KL, Mark DB et al.; Sudden Cardiac Death in Heart Failure Trial (SCD-HeFT) Investigators. Amiodarone or an implantable cardioverter-defibrillator for congestive heart failure. N Engl J Med, 2005; 352: 225–237.
119. Everitt MD, Saarel EV. Use of the wearable external cardiac defibrillator in children. Pacing Clin Electrophysiol. 2010; 33(6):742–6.
120. V. Tan, J. Yap, Li-Fern Hsu, R. Liew. Catheter ablation of ventricular fibrillation triggers and electrical storm. Europace. 2012.
121. Eifling M, Razavi M, Massumi A. The evaluation and management of electrical storm. Tex Heart Inst J. 2011; 38(2):111–21.
122. Proietti R, Sagone A. Electrical storm: Incidence, Prognosis and Therapy. Indian Pacing Electrophysiol J. 2011; 11(2):34–42.
123. Mallidi J, Nadkarni G, Berger R et al. Meta-Analysis of Catheter Ablation as an Adjunct to Medical Therapy for Treatment of Ventricular Tachycardia in Patients with Structural Heart Disease. Heart Rhythm 2011; 8(4):503–510.
124. Ардашев А.В, Склярова Т.Ф., Шаваров А.А. и соавт. Особенности центральной гемодинамики у пациентов с идиопатическими нарушениями ритма из области выходного тракта правого желудочка до радиочастотной катетерной абляции и в течение года после нее. Кардиология 2009; 3:4–9.
125. Schwartz PJ, Stone HL. Left stellectomy in the prevention of ventricular fibrillation caused by acute myocardial ischemia in conscious dogs with anterior myocardial infarction. Circulation 1980; 62:1256–1265.
126. Clementy N, Pierre B, Lallemand B et al. Long-term follow-up on high-rate cut-off programming for implantable cardioverter defibrillators in primary prevention patients with left ventricular systolic dysfunction. Europace 2012; 14(7):968–74.
127. Lee MS, Yang T, Dhoot J, Liao H. Meta-analysis of clinical studies comparing coronary artery bypass grafting with percutaneous coronary intervention and drugeluting stents in patients with unprotected left main coronary artery narrowings. Am J Cardiol. 2010; 105(8):1070–5.
128. Kim YH, Park DW, Kim WJ et al. Validation of SYNTAX (Synergy between PCI with Taxus and Cardiac Surgery) score for prediction of outcomes after unprotected left main coronary revascularization. JACC Cardiovasc Interv 2010; 3(6):612–23.
129. Niccoli G, De Felice F, Belloni F et al. Late (3 Years) Follow-Up of Successful Versus Unsuccessful Revascularization in Chronic Total Coronary Occlusions Treated by Drug Eluting Stent. Am J Cardiol. 2012 Jun 19. [Epub ahead of print].
130. Pegg TJ, Selvanayagam JB, Jennifer J et al. Prediction of global left ventricular functional recovery in patients with heart failure undergoing surgical revascularisation, based on late gadolinium enhancement cardiovascular magnetic resonance. J Cardiovasc Magn Reson 2010; 12:56.
131. Акчурин Р.С., Васюк Ю.А., Карпов Ю.А и соавт. Национальные рекомендации «Диагностика и лечение стабильной стенокардии». Кардиоваскулярная терапия и профилактика 2008; 7(6), Приложение 4.
132. Sarter B.H. Finkle J.K., Gerszten R.E. et al. What is the risk of sudden cardiac death in patients presenting with hemodynamically stable sustained ventricular tachycardia after myocardial infarction? J Am Coll Cardiol 1999; 28:122–129.
132 Список литературы Список литературы 133
133. Болдуева С.А., Леонова И.А., Бурак Т.Я. и соавт. Фракция выброса и другие предикторы внезапной кардиальной смерти у больных, перенесших инфаркт миокарда. Журнал сердечная едостаточность 2008; 9(3):111–117.
134. Болдуева С.А., Шабров А.В., Лебедев Д.С. и соавт. Прогнозирование и профилактика внезапной кардиальной смерти у больных, перенесших инфаркт миокарда. Кардиоваскулярная терапия и профилактика 2008; 7(3):56–62.
135. Uretsky B.F., Thygesen K., Daubert J.C. et al. Predictors of Mortality From Pump Failure and Sudden Cardiac Death in Patients With Systolic Heart Failure and Left Ventricular Dyssynchrony: Results of the CARE-HF Trial. Journal of Cardiac Failure 2008; 14 (8): 670–675.
136. Tada T., Shiba N., Watanabe J. Prognostic value of anemia in predicting sudden death of patients with diastolic heart failure. International Journal of Cardiology 2008; 128: 419–421.
137. Sabir I.N., Usher-Smith J.A., Huang C.L.H. Risk stratification for sudden cardiac death. Progress in Biophysics and Molecular Biology 2008; 98: 340–346.
138. Cannizzaro L.A., Piccini J.P., Patel U.D. Device Therapy in Heart Failure Patients With Chronic Kidney Disease. J Am Coll Cardiol 2011; 58 (9): 889–96.
139. Goldberger J.J., Cain M.E., Hohnloser S.H. et al. American Heart Association; American College of Cardiology Foundation; Heart Rhythm Society. American Heart Association/American College of Cardiology Foundation/Heart Rhythm Society scientific statement on noninvasive risk stratification techniques for identifying patients at risk for sudden cardiac death: a scientific statement from the American Heart Association Council on Clinical Cardiology Committee on Electrocardiography and Arrhythmias and Council on Epidemiology and Prevention. Circulation. 2008; 118(14):1497–1518.
140. Feruglio G, Rickards A, Steinbach K. Cardiac Pacing in the world: A survey of the state of the art in 1986. Pacing Clin Electrophysiol 1987; 10: 768–77.
141. Shaw DB, Holman RR, Gowers I. Survival in sinoatrial disorder (sick-sinus syndrome). Br Med J 1980; 280: 139–41.
142. Rosenqvist M, Brandt J, Schuller H. Long-term pacing in sinus node disease: effects of stimulation mode on cardiovascular morbidity and mortality. Am Heart J 1988; 116:16–22.
143. McAnulty JH, Rahimtoola SH, Murphy E et al. Natural history of ‘high-risk’ bundlebranch block: final report of a prospective study. N Engl J Med 1982; 307: 137–43.
144. Dhingra RC, Denes P, Wu D, Chuquimia R, Rosen KM. The significance of second degree atrioventricular block and bundle branch block. Observations regarding site and type of block. Circulation 1974; 49: 638–46.
145. Denes P, Dhingra RC, Wu D et al. Sudden death in patients with chronic bifascicular block. Arch Intern Med 1977; 137: 1005–10.
146. Peters RW, Scheinman MM, Modin C et al. Prophylactic permanent pacemakers for patients with chronic bundle branch block. Am J Med 1979; 66: 978–85.
147. Scheinman MM, Peters RW, Suave MJ et al. Value of the H-Q interval in patients with bundle branch block and the role of prophylactic permanent pacing. Am J Cardiol 1982; 50: 1316–22.
148. Scheinman MM, Weiss AN, Shafton E, Benowitz N, Rowland M. Electrophysiologic effects of procaine amide in patients with intraventricular conduction delay. Circulation 1974; 49: 522–9.
149. Tonkin AM, Heddle WF, Tornos P. Intermittent atrioventricular block: procainamide administration as a provocative test. Aust N Z J Med 1978; 8: 594–602.
150. Clemmensen P, Bates ER, Califf RM et al. Complete atrioventricular block complicating inferior wall acute myocardial infarction treated with reperfusion therapy. TAMI Study Group. Am J Cardiol 1991; 67: 225–30.
151. Behar S, Zissman E, Zion M et al. Prognostic significance of second-degree atrioventricular block in inferior wall acute myocardial infarction. SPRINT Study Group. Am J Cardiol 1993; 72: 831–4.
152. Berger PB, Ruocco NA, Ryan TJ et al. Incidence and prognostic implications of heart block complicating inferior myocardial infarction treated with thrombolytic therapy: results from TIMI II. J Am Coll Cardiol 1992; 20: 533–40.
153. Sholler GF, Walsh EP. Congenital complete heart block inpatients without anatomic cardiac defects. Am Heart J 1989; 118: 1193–8.
154. Michaelsson M, Jonzon A, Riesenfeld T. Isolated congenital complete atrioventricular block in adult life. A prospective study. Circulation 1995; 92: 442–9.
155. Michaelsson M, Engle MA. Congenital complete heart block: an international study of the natural history. Cardiovasc Clin 1972; 4: 85–101.
156. Solti F, Szatmary L, Vecsey T, Renyi-Vamos F, Bodor E. Congenital complete heart block associated with QT prolongation. Eur Heart J 1992; 13: 1080–3.
157. Silka MJ, Manwill JR, Kron J, McAnulty JH. Bradycardiamediated tachyarrhythmias in congenital heart disease and responses to chronic pacing at physiologic rates. Am J Cardiol 1990; 65: 488–93.
158. Ardashev A, Makarenko A, Zhelyakov E, Shavarov A. Atrioventricular Nodal Reentrant Tachycardia Treatment using Novel Potential. Asian Cardiovasc Thorac Ann 2010; 18:529–535.
159. Kappos KG, Kranidis AJ, Anthopoulos LP. Torsades de pointes following radiofrequency catheter His ablation. Int J Cardiol 1996; 57: 177–9.
160. Satoh T, Zipes DP. Rapid rates during bradycardia prolong ventricular refractoriness and facilitate ventricular tachycardia induction with cesium in dogs. Circulation 1996; 94:217–27.
161. Zehender M, Buchner C, Meinertz T, Just H. Prevalence, circumstances, mechanisms, and risk stratification of sudden cardiac death in unipolar single-chamber ventricular pacing. Circulation 1992; 85: 596–605.
162. Taylor MR, Carniel E, Mestroni L. Cardiomyopathy, familial dilated. Orphanet J Rare Dis 2006; 1: 27.
163. Richardson P, McKenna W, Bristow M et al. Report of the 1995 World Health Organization/International Society and Federation of Cardiology Task Force on the Definition and Classification of Cardiomyopathies. Circulation 1996; 93 (5): 841–842.
164. Coughlin S.S., Myers L., Michaels R.K. What explains black-white differences in survival in idiopathic dilated cardiomyopathy? The Washington, DC, Dilated Cardiomyopathy Study. J Natl Med Assoc 1997; 89: 277–282.
165. Coughlin S.S., Neaton J.D., Sengupta A., Kuller L.H. Predictors of mortality from idiopathic dilated cardiomyopathy in 356,222 men screened for the Multiple Risk Factor Intervention Trial. Am J Epidemiol 1994; 139: 166–172.
166. Dec GW, Fuster V. Idiopathic dilated cardiomyopathy. N Engl J Med 1994; 331:1564–1575.
167. Di LA, Secoli G, Perkan A et al. Changing mortality in dilated cardiomyopathy. The Heart Muscle Disease Study Group. Br Heart J 1994; 72: S46–S51.
168. Sugrue DD, Rodeheffer RJ, Codd MB et al. The clinical course of idiopathic dilated cardiomyopathy. A population-based study. Ann Intern Med 1992; 117: 117–123.
169. Komajda M, Jais JP, Reeves F et al. Factors predicting mortality in idiopathic dilated cardiomyopathy. Eur Heart J 1990; 11:824–831.
170. Huikuri HV, Castellanos A, Myerburg RJ. Sudden death due to cardiac arrhythmias. N Engl J Med 2001; 345:1473–82.
171. P. Charron, M. Arad, E. Arbustini et al. Genetic counselling and testing in cardiomyopathies: a position statement of the European Society of Cardiology Working group on Myocardial and Pericardial Diseases. Eur J Heart; 2010; 31: 2715–2728.
172. Meune C, Van Berlo JH. Anselme F et al. Primary prevention of sudden death in patients with lamin A/C gene mutations. N Engl J Med 2006; 354: 209–210.
173. van Berlo JH, de Voogt WG, van der Kooi AJ et al. Meta-analysis of clinical characteristics of 299 carriers of LMNA gene mutations: do lamin A/C mutations portend a high risk of sudden death? J Mol Med. 2005; 83(1): 79–83.
174. Gersh B.J., Maron B.J., Bonow R.O. et al. 2011 ACCF/AHA Guideline for the Diagnosis and Treatment of Hypertrophic Cardiomyopathy: A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines American Association for Thoracic Surgery, American Society of Echocardiography, American Society of Nuclear Cardiology, Heart Failure Society of America, Heart Rhythm Society, Society for Cardiovascular Angiography and Interventions, Society of Thoracic Surgeons, Circulation. 2011; 124:2761–2796.
175. Юзвинкевич С.А. Электрокардиотерапия гипертрофической кардиомиопатии. Клиническая аритмология, под ред. проф. Ардашева А.В. М.: МЕДПРАКТИКАМ; 2009:532–547.
176. Elliott P.M., Poloniecki J., Dickie S. et al. Sudden death in hypertrophic cardiomyopathy: identification of high risk patients. J Am Coll Cardiol. 2000; 36:2212–2218.
177. Elliott P.M., Gimeno Blanes J.R., Mahon N.G. et al. Relation between severity of left-ventricular hypertrophy and prognosis in patients with hypertrophiccardiomyopathy. Lancet. 2001; 357:420–424.
178. Maron B.J., Semsarian C., Shen W.K. et al. Circadian patterns in the occurrence of malignant ventricular tachyarrhythmias triggering defibrillator interventions in patients with hypertrophic cardiomyopathy. Heart Rhythm. 2009; 6:599–602.
179. Elliott P.M., Gimeno J.R., Tome M.T. et al. Left ventricular outflow tract obstruction and sudden death risk in patients with hypertrophic cardiomyopathy. Eur Heart J. 2006; 27:1933–1941.
180. Maron B.J. Risk stratification and role of implantable defibrillators for prevention of sudden death in patients with hypertrophic cardiomyopathy. Circ J. 2010; 74:2271–2282.
181. Spirito P., Autore C., Rapezzi C. et al. Syncope and risk of sudden death in hypertrophic cardiomyopathy. Circulation. 2009; 119:1703–1710.
182. Maron B.J., Niimura H., Casey S.A. et al. Development of left ventricular hyperthrophy in adults in hypertrophic cardiomyopathy caused by cardiac myosin-binding protein C gene mutation. J Am Coll Cardiol. 2001; 38:315–321.
183. Rosenzweig A., Watkins H., Hwang D.S. et al. Preclinical diagnosis of familial hypertrophic cardiomyopathy by genetic analysis of blood lymphocytes. N Engl J Med. 1991; 325:1753–1760.
184. Spada M., Pagliardini S., Yasuda M. et al. High incidence of later-onset Fabry disease revealed by newborn screening. Am J Hum Genet. 2006; 79:31–40.
185. Maron B.J., McKenna W.J., Danielson G.K. et al. ACC/ESC clinical experts consensus document on hypertrophic cardiomyopathy. J Am Coll Cardiol. 2002; 42:1687–1713.
186. Oerger D.M., Picard M.H., Palacios I.F. et al. Time course of pressure gradient response after first alcohol septal ablation for obstructive hypertrophic cardiomyopathy. Am J Cardiol. 2006; 97:1511–1514.
187. Ciampi Q., Betocchi S., Lombardi R. et al. Hemodynamic determinants of exerciseinduced abnormal blood pressure response in hypertrophic cardiomyopathy. J Am Coll Cardiol. 2002; 40:278–284.
188. Olivotto I., Maron B.J., Montereggi A. et al. Prognostic value of systemic blood pressure response during exercise in a community-based patient population with hypertrophic cardiomyopathy. J Am Coll Cardiol. 1999; 33:2044–2051.
189. Rubinshtein R., Glockner J.F., Ommen S.R. et al. Characteristics and clinical significance of late gadolinium enhancement by contrast-enhanced magnetic resonance imaging in patients with hypertrophic cardiomyopathy. Circ Heart Fail. 2010; 3:51–58.
190. Maron B.J., Spirito P., Shen W.K. et al. Implantable cardioverter-defibrillators and prevention of sudden cardiac death in hypertrophic cardiomyopathy. JAMA. 2007; 298:405–412.
191. Marcus F.I., McKenna W.J., Sherrill D. et al. Diagnosis of arrhythmogenic right ventricular cardiomyopathy/dysplasia. Proposed modification of the Task Force Criteria. Circulation 2010; 121; 1533–1541.
192. Basso C., Corrado D., Marcus F.I. et al. Arrhythmogenic right ventricular cardiomyopathy. Lancet 2009; 373:1289–1300.
193. Norman M.W., McKenna W.J. Arrhythmogenic right ventricular dysplasia/cardiomyopathy: perspectives on disease. Z Kardiol 1999; 88:550–554.
194. Nava A., Bauce B., Basso C. et al. Clinical profile and long-term follow-up of 37 families with arrhythmogenic right ventricular cardiomyopathy. J Am Coll Cardiol 2000; 36:2226–2233.
195. Azaouagh A., Churzidse S., Konorza T., Erbel R. Arrhythmogenic right ventricular cardiomyopathy/dysplasia: a review and update. Clin Res Cardiol 2011; 100:383–394.
196. Basso C., Corrado D., Thiene G. Cardiovascular causes of sudden death in young individuals including athletes. Cardiol Rev 1999; 7:127–135.
197. Гордеева М.В., Митрофанова Л.Б., Пахомов А.В. и др. Внезапная сердечная смерть молодых людей. Вест Аритм 2012; 68:27–37.
198. Яшин С.М., Думпис Я.Ю., Вайнштейн А.Б. Возможно ли поставить диагноз аритмогенной кардиомиопатии правого желудочка с помощью простого неинвазивного обследования, включающего ЭКГ диагностику и эхокардиографию? Вестник Аритмологии 2008; Приложение А: Программа и тезисы VIII Международного славянского конгресса по электростимуляции и клинической электрофизиологии сердца «Кардиостим»: 171.
199. Corrado D., Basso C., Thiene G. Arrhythmogenic right ventricular cardiomyopathy: diagnosis, prognosis, and treatment. Heart 2000; 83:588–595.
200. Gemayel C., Pelliccia A., Thompson P.D.. Arrhythmogenic right ventricular cardiomyopathy. J Am Coll Cardiol 2001; 38:1773–81.
201. Fung W.H., Sanderson J.E. Clinical profile of arrhythmogenic right ventricular cardiomyopathy in Chinese patients. Int J Cardiol 2001; 81:9–18.
202. Ардашев А. Клиническая аритмология. М.: МЕДПРАКТИКА-М, 2009.
203. Кушаковский М.С. Аритмии сердца. СПб.: Фолиант, 1998. – 640 с.
204. Ардашев А.В, Рыбаченко МС., Желяков Е.Г. и соавт. Синдром Вольфа–Паркинсона–Уайта: классификация, клинические проявления, диагностика и
лечение. Кардиология 2009; 10:84–94.
205. Rodriguez L-M, de Chillou C, Schlapfer J. Age at onset and gender of patients with different types of supraventricular tachycardias. Am J Cardiol 1992; 70:1213–1215.
206. Klein GJ, Bashore TM, Sellers TD. Ventricular fibrillation in the Wolff–Parkinson–White syndrome. N Engl J Med 1979; 301:1080–1085.
207. Timmermans C, Smeets JLRM, Rodriguerz LM. Aborted sudden death in the WPW syndrome. Am. J Cardiol 1995; 76: 492–494.
208. Montoya PT, Brugada P, Smeets J. Ventricular fibrillation in the Wolff–Parkinson–White syndrome. Eur Heart J l991; A44–l50.
209. Epstein A, Miles W, Garson Jr A. Personal and Public Safety Issues Related to Arrhythmias. That May Affect Consciousness: Implications for Regulation and
Physician Recommendations. Circulation 1996; 94:1147–1166.
210. Pappone C, Santinelli V, Manguso F et al. A randomized study of prophylactic catheter ablation in asymptomatic patients with the Wolff–Parkinson–White syndrome.
N Engl J Med 2003; 349:1803–11.
211. Yi-Jen Chen, Shih-Ann Chen, Ching-Tai Tai. Role of atrial electrophysiology and autonomic nervous system in patients with supraventricular tachycardia and paroxysmal
atrial fibrillation. JACC 1998; Vol 32 No 3: p.732–738.
212. Bromberg BI, Linsay BD, Cain ME. Impact of history and electrophysiologic charactetezation of accessory pathway on management strategies to reduce sudden death
among children with WPW syndrom. JACC 1996; Vol 27/ No 3:690–5.
213. Wang Y, Scheinman MM, Chien WW. JC. Patients with supraventricular tachycardia presenting with aborted sudden death: incidence, mechanism and long-term followup.
JACC 1991; 18:1711–1719.
214. Палеев Н.Р. Миокардиты. Болезни органов кровообращения: Руководство для врачей. Под ред. Е.И. Чазова. – М.: Медицина, 1997. – С. 543–561.
215. Carniel E., Sinagra G., Bussani R. et al. Fatal myocarditis: morphologic and clinical features. Ital. Heart. J. 2004; 5 (9): 702–6.
216. Kuhl U., Pauschinger M., Noutsias M. et al. High prevalence of viral genomes and multiple viral infections in the myocardium of adults with „idiopathic“ left ventricular
dysfunction. Circulation. 2005; 111 (7): 887–93.
217. Kyto V., Saraste A., Voipio-Pulkki L-M., Saukko P. Incidence of fatal myocarditis: a population-based study in Finland. Am. J. Epidem. 2007; 165 (5): 570–4.
218. Арутюнов Г.П. Миокардиты (часть 1). Сердце. 2010; 9 (5): 297–306.
219. Fabre A., Sheppard M.N. Sudden adult death syndrome and other non-ischaemic causes of sudden cardiac death. Heart. 2006; 92 (3): 316–20.
220. Maron B.J., Doerer J.J., Haas T.S. Sudden death in young competitive athletes: analysis of 1866 deaths in the United States, 1980–2006.Circulation. 2009; 119 (8): 1085–92.
221. Towbin J.A., Lowe A.M., Colan S.D. et al. Incidence, causes, and outcomes of dilated cardiomyopathy in children.JAMA. 2006; 296 (15): 1867–76.
222. Hufnagel G., Pankuweit S., Richter A. et al. The European Study of Epidemiology and Treatment of Cardiac Inflammatory Diseases (ESETCID). Herz. 2000; 25 (3): 279–85.
223. Cooper L.T., Berry G.J., Shabetai R. Idiopathic giant-cell myocarditis-natural history and treatment. Multicenter Giant Cell Myocarditis Study Group Investigators. N. Engl. J. Med. 1997; 336 (26): 1860–6.
224. Rassi A. Jn., Rassi A., Little W.C. Chaga’s heart disease. Clin. Cardiol. 2000; 23: 883–9.
225. Гогин Е.Е., Тюрин В.П. Инфекционные эндокардиты // Диагностика и лечение внутренних болезней: Рук. для врачей / Под ред. Ф.И. Комарова. – М.: Медицина, 1996. – Т.1. – С.300–318.
226. Тюрин В.П. Инфекционные эндокардиты: руководство / Под ред. акад. РАМН Ю.Л. Шевченко. – 2 е изд., доп. и перераб. – М. : ГЭОТАР Медиа, 2012. – 368 с. Nunley D.L., Perlman P.E. Endocarditis. Changing trends in epidemiology, clinical and microbiological spectrum. Postgrad. Med. 1993; 93:235–47.
227. Murdoch D.R., Corey G.R., Hoen B. et al. Clinical presentation, etiology, and outcome of infective endocarditis in the 21st century: the International Collaboration on Endocarditis-Prospective Cohort Study. Arch Intern Med 2009; 169: 463–73.
228. Демин А.А., Скопин И.И., Соболева М.К. и др. Инфекционный эндокардит: новые стандарты диагностики и лечения. Клин. Медицина. 2003; 6: 68–71.
229. Tleyjeh I.M., Abdel-Latif A., Rahbi H. et al. A systematic review of population-based studies of infective endocarditis. Chest. 2007; 132: 1025–35.
230. Тюрин В.П. Современные подходы к терапии инфекционного эндокардита. Сердце. 2010; 9 (5): 307–12.
231. San Roman J.A., Lopez J., Vilacosta I. et al. Prognostic stratification of patients with left-sided endocarditis determined at admission. Am. J. Med. 2007; 120: 369 e1–e7.
232. Delahaye F., Alla F., Beguinot I. et al. In-hospital mortality of infective endocarditis: prognostic factors and evolution over an 8-year period. Scand. J. Infect. Dis. 2007; 39: 849–57.
233. Mylonakis E., Calderwood S.B. Infective endocarditis in adults. N. Angl. J. Med. 2001; 345: 1318–30.
234. Aguado J.M., Gonzalez-Vilchez F., Martin-Duran R. et al. Perivalvular abscess associated with endocarditis: clinical features and diagnostic accuracy of twodimensional echocardiography. Chest 1993; 104: 88–93.
235. National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III) final report. Circulation 2002; 106: 3143–3421.
236. Grundy S.M., Cleeman J.I., Daniels S.R. et al. Diagnosis and Management of the Metabolic Syndrome. An American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement. Circulation 2005; 112: 2735–2752.
237. Alberti K.G.M.M., Eckel R.H., Grundy S.M. et al. Harmonizing the metabolic syndrome: a joint interim statement of the International Diabetes Federation task force on epidemiology and prevention; National Heart, Lung, and Blood Institute; American Heart Association; World Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 2009; 120: 1640–1645.
238. Рекомендации экспертов ВНОК по диагностике и лечению метаболического синдрома. Кардиоваскулярная терапия и профилактика 2009; №6, приложение №2.
239. Чазова И.Е., Мычка В.Б. Метаболический синдром. Москва, Медиа Медика, 2004, 168 с.
240. Консенсус российских экспертов по проблеме метаболического синдрома: определение, диагностические критерии, первичная профилактика и лечение. Consilium Medicum 2010; 12 (№5): 5–11.
241. Soydinc S., Davutoglu V., Akcay M. Uncomplicated metabolic syndrome is associated with prolonged electrocardiographic QTc interval and QTc dispersion. Ann Noninvasive Electrocardiol 2006; 11: 313–317.
242. Paksoy F., Ulaє T., Bes C. et al. Corrected Qt interval in patients with metabolic syndrome. Dicle Med J 2011; 38: 274–277.
243. Li W., Bai Y., Sun K. et al. Patients with Metabolic Syndrome Have Prolonged Corrected QT Interval (QTc). Clin Cardiol 2009; 32: E93–E99.
244. Сапожникова И.Е., Тарловская Е.И., Тарловский А.К., Соболев А.А. Дисперсия интервалов Q-T И J-T у пациентов с артериальной гипертензией в сочетании
с метаболическими нарушениями в рамках инсулинорезистентного синдромаОМА. Вестник аритмологии 2001; №24: 22–26.
245. Рябыкина Г.В., Шишова Т.А., Лаптев Д.Н., и соавт. Динамика артериального давления, вариабельности ритма сердца и QTс у больных с метаболическим синдромом при лечении селективным бета-блокатором и бигуанидами. Системные гипертензии 2009; №3: 38–56.
246. Park S.K., Schwartz J., Weisskopf M. et al. Low-Level Lead Exposure, Metabolic Syndrome, and Heart Rate Variability: The VA Normative Aging Study. Environ Health Perspect 2006; 114: 1718–1724.
247. Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology. Heart Rate Variability. Standards of Measurements, Physiological Interpretation, and Clinical Use. Circulation 1996; 93: 1043–1065.
248. Koskinen T., Kдhцnen M., Jula A. et al. Metabolic syndrome and short-term heart rate variability in young adults. The cardiovascular risk in young Finns study. Diabet Med 2009; 26: 354–361.
249. Min K.B., Min J.Y., Paek D., Cho S.I. The impact of the components of metabolic syndrome on heart rate variability: using the NCEP-ATP III and IDF definitions. Pacing Clin Electrophysiol. 2008; 31: 584–591.
250. Liao D., Sloan R.P., Cascio W.E. et al. Multiple Metabolic Syndrome Is Associated With Lower Heart Rate Variability: The Atherosclerosis Risk in Communities Study. Diabetes Care 1998; 21: 2116–2122.
251. Невзоров В.А., Абрамов Е.А., Власенко А.Н. Особенности липидного спектра, вариабельности артериального давления и сердечного ритма у больных с клиническими проявлениями метаболического синдрома. Вестник аритмологии 2004; №36: 27–30.
252. Аничков Д.А., Шостак Н.А., Котлярова Л.А., Иванов Д.С. Дисфункция вегетативной нервной системы у больных метаболическим синдромом: исследование вариабельности сердечного ритма. Кардиоваскул. тер. и профилактика 2005; 4 (4): 85–90.
253. Кратнов А.Е., Климачева О.В., Третьяков С.В. Влияние факторов метаболического синдрома на изменение вариабельности ритма сердца. Современные технологии в медицине 2011; №3: 102–105.
254. Хурс Е.М., Андреев П. В., Поддубная А. В., и соавт. Вегетативный дисбаланс в патогенезе метаболического синдрома. Клиническая медицина 2010; 88(6): 39–42.
255. Минаков Э.В., Кудаева Л.А. Изучение особенностей формирования кардиальной нейропатии улиц с метаболическим синдромом и нарушением углеводного обмена (по данным анализа вариабельности сердечного ритма). Саратовский научно-медицинский журнал 2010; 6 (3): 582–585.
256. Ferrara A.L., Vaccaro O., Cardoni O. et al. Is there a relationship between left ventricular mass and plasma glucose and lipids independent of body mass index? Results of the Gubbio Study. Nutr Metab Cardiovasc Dis 2003; 13: 126–132.
257. Ferrara L.A., Cardoni O., Mancini M., Zanchetti A. Metabolic syndrome and left ventricular hypertrophy in a general population. Results from the Gubbio Study. J Hum Hypertens 2007; 21: 795–801.
258. Guerra F., Mancinelli L., Angelini L. et al. The Association of Left Ventricular Hypertrophy with Metabolic Syndrome is Dependent on Body Mass Index in Hypertensive Overweight or Obese Patients. PLoS One 2011; 6(1): e16630.
259. Higham P.D., Adams P.C., Murray A., Campbell R.W. Plasma potassium, serum magnesium and ventricular fibrillation: a prospective study. Q J Med 1993; 86: 609–617.
260. Marques J.L., George E., Peacey S.R. et al. Altered ventricular repolarization during hypoglycaemia in patients with diabetes. Diabet Med 1997; 14: 648–654.
261. Heller S.R. Abnormalities of the electrocardiogram during hypoglycaemia: the cause of the dead in bed syndrome? Int J Clin Pract Suppl 2002; 129: 27–32.
262. Lattimore J.L., Celermajer D.S., Wilcox I. Obstructive sleep apnea and cardiovascular disease. JACC 2003; 41: 1429–1437.
263. Vgontzas A.N., Bixler E.O., Chrousos G.P. Sleep apnea is a manifestation of the metabolic syndrome. Sleep Med Rev 2005; 9:211–224.
264. Somers V.K., White D.P., Amin R. et al. Sleep Apnea and Cardiovascular Disease An American Heart Association/American College of Cardiology Foundation Scientific Statement From the American Heart Association Council for High Blood Pressure Research Professional Education Committee, Council on Clinical Cardiology, Stroke Council, and Council on Cardiovascular Nursing. JACC 2008; 52; 686–717.
265. Sharma S.K., Agrawal S., Damodaran D. et al. CPAP for the Metabolic Syndrome in Patients with Obstructive Sleep Apnea. N Engl J Med 2011; 365: 2277–2286.
266. Drenick E.J. Fisler J.S. Sudden cardiac arrest in morbidly obese surgical patients unexplained after autopsy. Am J Surg 1988: 155: 720–726.
267. Sjostrom LV. Mortality of severely obese subjects. Am J Clin Nutt 1992:55:516S–23S.
268. Bharati S., Lev M. Cardiac conduction system involvement in sudden death of obese young people. Am Heart J 1995:129:273–81.
269. Frank S., Colliver J.A., Frank A. The electrocardiogram in obesity: statistical analysis of 1,029 patients. JACC 1986; 7: 295–299.
270. Alpert M.A., Terry B.E., Cohen M.V. et al. The electrocardiogram in morbid obesity. Am J Cardiol 2000: 85: 908–910.
271. Mshui M.E., Saikawa T., Ito K. et al. QT interval and QT dispersion before and after diet therapy in patients with simple obesity. Proc Soc Exp Biol Med 1999; 220:133–138.
272. Alpert M.A. Obesity cardiomyopathy: pathophysiology and evolution of the clinical syndrome. Am J Med Sci 2001; 321: 225–236.
273. Wong C., Marwick T.H. Obesity cardiomyopathy: pathogenesis and pathophysiology. Nat Clin Pract Cardiovasc Med 2007; 4: 436–443.
274. Mac Mahon S.W., Wilcken D.E., Macdonald G.J. The effect of weight reduction on left ventricular mass. A randomized controlled trial in young, overweight hypertensive patients. N Engl J Med 1986; 314: 334–339.
275. Alpert M.A., Lambert C.R., Terry B.E. et al. Effect of weight loss on left ventricular mass in nonhypertensive morbidly obese patients. Am J Cardiol 1994; 73: 918–921.
276. Carella M.J., Mantz S.L., Rovner D.R. et al. Obesity, adiposity, and lengthening of the QT interval: improvement after weight loss. Int J Obes Relat Metab Disord 1996; 20: 938–942.
277. Singh B.N., Gaarder T.D., Kanegae T. et al. Liquid protein diets and torsade de pointes. JAMA 1978; 240: 115–119.
278. Doherty J.U., Wadden Т.А., Zuk L. et al. Long-term evaluation of cardiac function in obese patients treated with a very-low-calorie diet: a controlled clinical study of patients without underlying cardiac disease. Ain J Clin Nutr 1991; 53: 854–858.
279. Fisler J.S. Cardiac effects of starvation and semistarvation diets: safety and mechanisms of action. Am J Clin Nutr 1992; 56: 230S–234S.
280. Surawicz B., Waller B.F. The enigma of sudden cardiac death related to dieting. Can J Cardiol 1995; 11: 228–231.
281. Ahmed W., Flynn M.A., Alpert M.A. Cardiovascular complications of weight reduction diets. Am J Med Sci 2001; 321: 280–284.
282. Neumarker K.J. Mortality and sudden death in anorexia nervosa. Int J Eat Disord 1997; 21: 205–212.
283. Lupoglazoff J.M., Berkane N., Denjoy I. et al. Cardiac consequences of adolescent anorexia nervosa. Arch Mai Coeur Vaiss 2001; 94: 494–498.
284. Isner J.M., Roberts W.C., Heymsfield S.B. et al. Anorexia nervosa and sudden death. Ann Intern Med 1985; 102: 49–52.
285. Swenne I., Larsson P.T. Heait risk associated with weight loss in anorexia nervosa and eating disorders: lisk factors for QTc interval prolongation and dispersion. Acta Paediatr 1999; 88: 304–309.
286. Brooks M.J., Melnik G. The refeeding syndrome: an approach to understanding its complications and preventing its occurrence. Pharmacotherapy 1995; 15: 713–726.
287. Schocken D.D., Holloway I.D., Powers P.S. Weight loss and the heart. Effects of anorexia nervosa and starvation. Arch Intern Med 19898 149: 877–881.
288. Solomon S.M., Kirby D.F. The refeeding syndrome: a review. JPEN J Parenter Enteral Nutr 1990; 14: 90–97.
289. Weinsier RL. Krumdieck CL. Death resulting from overzealous total parenteral nutrition: the refeeding syndrome revisited. Am J Clin Nutr 1981; 34: 393–399.
290. Bray G.A., Bellanger T. Epidemiology, Trends, and Morbidities of Obesity and the Metabolic Syndrome. Endocrine 2006; 29: 109–117.
291. Priori S. G., Aliot E., Blomstrom-Lundqvist C. et al. Task Force on Sudden Cardiac Death of the European Society of Cardiology. Eur Heart J 2001; 22: 1374–1450.
292. Empana J-P., Duciemetiere P., Balkau B., Jouve X. Contribution of the metabolic syndrome to sudden death risk in asymptomatic men: the Paris Prospective Study I.
Eur Heart J 2007; 9: 1149–1154.
293. Mulpuru S. K., Krummen D. E., Narayan S. M.: Sudden Death Risk in Type 2 Diabetic patients Post Myocardial Infarction: A “Sweet” Opportunity? Heart Rhythm. 2010; 7: 1404–1405.
294. Jouven X, Desnos M, Guerot C, Ducimetiere P. Predicting sudden death in the population: the Paris Prospective Study I. Circulation 1999; 99:1978–83.
295. Albert CM, Chae CU, Grodstein F et al. Prospective study of sudden cardiac death among women in the United States. Circulation 2003; 107:2096–2101.
296. Maffei P., Martini C., Milanesi A. et al. Late potentials and ventricular arrhythmias in acromegaly. Int J Cardiol 2005 , 30; 104:197–203.
297. Kahaly G, Olshausen KV, Mohr-Kahaly S et al. Arrhythmia profile in acromegaly. Eur Heart J, 1992; 13:51–56.
298. Weiss V, Sonka K, Pret lM et al. Prevalence of the sleep apnea syndrome in acromegaly population. J Endocrinol Invest 2000 23:515–519.
299. Arias M. A , Pachon M.; Rodriguez-Padial L.: Ventricular tachycardia in acromegaly Rev Port Cardiol 2011; 30: 223–226.
300. Herrmann BL, Bruch C, Saller B, Ferdin S et al. Occurrence of ventricular late potentials in patients with active acromegaly. Clin Endocrinol (Oxf) 2001; 55:201–207.
301. Alpert MA. Sudden cardiac arrest and sudden cardiac death on dialysis: Epidemiology, evaluation, treatment, and prevention. Hemodial Int. 2011; 15 Suppl 1:S22–9.
302. Drechsler C, Grootendorst DC, Pilz S et al. ,Wasting and sudden cardiac death in hemodialysis patients: a post hoc analysis of 4D (Die Deutsche DiabetesDialyseStudie). Am J Kidney Dis. 2011; 58(4):599–607.
303. Kanbay M, Solak Y, Covic A, Goldsmith D. Sudden cardiac death in patients with chronic kidney disease: prevention is the sine qua non. Kidney Blood Press Res. 2011; 34(4):269–76.
304. Pena VS, Miravitlles M, Gabriel R et al. Geographic variations in prevalence and underdiagnosis of COPD: results of the IBERPOC multicentre epidemiological study. Chest 2000; 118,981–989.
305. Tálamo C, de Oca MM, Halbert R et al. Diagnostic labeling of COPD in five Latin American cities Chest. 2007 Jan; 131(1):60–7.
306. Краснова Ю.Н., Гримайлова Е.В., Дзизинский А.А., Черняк Б.А. Распространенность хронической обструктивной болезни легких в Иркутской области. Пульмонология 2006 №1б с. 98–102.
307. Jemal A, Ward E, Hao Y, Thun M. Trends in the leading causes of death in the United States, 1970–2002. JAMA 2005; 294:1255–1259.
308. The Global Initiative for Chronic Obstructive Lung Disease (GOLD). Update 2011. www.goldcopd.com.
309. Sin DD, Wu L, Man SF. The relationship between reduced lung function and cardiovascular mortality: a population-based study and a systematic review of the literature. Chest 2005; 127:1952–1959.
310. Schunemann, HJ, Dorn, J, Grant, BJ et al. Pulmonary function is a long-term predictor of mortality in the general population: 29-year follow-up of the Buffalo Health Study. Chest 2000; 118,656–664.
311. Calverley PM, Anderson JA, Celli B et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007; 356:775–789.
312. Hawkins NM, Huang Z, Pieper KS et al. Chronic obstructive pulmonary disease is an independent predictor of death but not atherosclerotic events in patients with myocardial infarction: analysis of the Valsartan in Acute Myocardial Infarction Trial (VALIANT). Eur J Heart Fail. 2009 Mar; 11(3):292–8.
313. Mapel DW, Dedrick D, Davis K. Trends and cardiovascular co-morbidities of COPD patients in the Veterans Administration medical system, 1991–1999. COPD 2005; 2:35–41.
314. DeSilva RA. Central nervous system risk factors for sudden cardiac death Ann N Y Acad Sci 1982; 382:143–161.
315. Cox GF, Kunkel LM. Dystrophies and heart disease Curr Opin Cardiol 1997; 12:329–343.
316. Pelargonio G, Dello RA, Sanna T et al. Myotonic dystrophy and the heart Heart 2002; 88:665–670.
317. Munoz J, Sanjuan R, Morell JS et al. Ventricular tachycardia in Duchenne’s muscular dystrophy Int J Cardiol 1996; 54:259–262.
318. Samuels MA. Neurally induced cardiac damage. Definition of the problem Neurol Clin 1993; 11:273–292.
319. Merino JL, Peinado R. Arrhythmias associated with neuromuscular disorders Card Electrophysiol Rev 2002; 6:132–135.
320. Becane HM, Bonne G, Varnous S et al. High incidence of sudden death with conduction system and myocardial disease due to lamins A and C gene mutation Pacing Clin Electrophysiol 2000; 23:1661–1666.
321. Colleran JA, Hawley RJ, Pinnow EE et al. Value of the electrocardiogram in determining cardiac events and mortality in myotonic dystrophy Am J Cardiol 1997; 80:1494–1497.
322. Corrado G, Lissoni A, Beretta S et al. Prognostic value of electrocardiograms, ventricular late potentials, ventricular arrhythmias, and left ventricular systolic dysfunction in patients with Duchenne muscular dystrophy Am J Cardiol 2002; 89:838–841.
323. Ducceschi V, Nigro G, Sarubbi B et al. Autonomic nervous system imbalance and left ventricular systolic dysfunction as potential candidates for arrhythmogenesis in Becker muscular dystrophy Int J Cardiol 1997; 59:275–279.
324. Perloff JK, Stevenson WG, Roberts NK et al. Cardiac involvement in myotonic muscular dystrophy (Steinert’s disease)a prospective study of 25 patients. Am J Cardiol 1984; 54:1074–1081.
325. Hiromasa S, Ikeda T, Kubota K et al. Myotonic dystrophyambulatory electrocardiogram, electrophysiologic study, and echocardiographic evaluation. Am Heart J 1987; 113:1482–1488.
326. Stevenson WG, Perloff JK, Weiss JN et al. Facioscapulohumeral muscular dystrophyevidence for selective, genetic electrophysiologic cardiac involvement. J Am Coll Cardiol 1990; 15:292–299.
327. James TN, Fisch C. Observations on the cardiovascular involvement in Friedreich’s ataxia Am Heart J 1963; 66:164–175.
328. Roberts NK, Perloff JK, Kark RA. Cardiac conduction in the Kearns-Sayre syndrome (a neuromuscular disorder associated with progressive external ophthalmoplegia and pigmentary retinopathy). Report of 2 cases and review of 17 published cases Am J Cardiol 1979; 44:1396–1400.
329. Charles R, Holt S, Kay JM et al. Myocardial ultrastructure and the development of atrioventricular block in Kearns-Sayre syndrome Circulation 1981; 63:214–219.
330. James TN. Observations on the cardiovascular involvement, including the cardiac conduction system, in progressive muscular dystrophy Am Heart J 1962; 63:48–56.
331. Tawil R, Ptacek LJ, Pavlakis SG et al. Andersen’s syndrome: potassium-sensitive periodic paralysis, ventricular ectopy, and dysmorphic features. Ann Neurol. 1994 Mar; 35(3):326–30.
332. Sansone V, Griggs RC, Meola G et al. Andersen’s syndrome: a distinct periodic paralysis. Ann Neurol. 1997 Sep; 42(3):305–12.
333. Levitt LP, Rose LI, Dawson DM. Hypokalemic periodic paralysis with arrhythmia. N Engl J Med. 1972 Feb 3; 286(5):253–4.
334. Gutmann L. Periodic paralyses. Neurol Clin. 2000 Feb; 18(1):195–202.
335. Junker J, Haverkamp W, Schulze-Bahr E et al. Amiodarone and acetazolamide for the treatment of genetically confirmed severe Andersen syndrome. Neurology. 2002 Aug 13; 59(3):466.
336. Bokenkamp R, Wilde AA, Schalij MJ, Blom NA. Flecainide for recurrent malignant ventricular arrhythmias in two siblings with Andersen–Tawil syndrome. Heart Rhythm 2007; 4:508–11.
337. Pellizzon OA, Kalazich L, Ptacek LJ et al. Flecainide suppresses bidirectional ventricular tachycardia and reverses tachycardia-induced cardiomyopathy in Andersen–Tawil syndrome. J Cardiovasc Electrophysiol 2008; 19:95–7.
338. Макаров Л.М., Комолятова В.Н., Колосов В.О. и соавт. Синдром АндерсенаТавила. Эффективность препаратов IC класса. Описание случая. Кардиология 2012 (в печати).
339. Reichenbach, H., Meister, E. M., Theile, H. Herz-Hand-Syndrom: Eine neue Cariante mit Erregungsleitungsstorungen am Herzen und Syndaktylien einschleisslich ossarer Veranderungen an Handen und Fussen. Kinderarztl. Prax. 1992, 60: 54–56.
340. Marks, M. L., Trippel, D. L., Keating, M. T. Long QT syndrome associated with syndactyly identified in females. Am. J. Cardiol. 1995, 76: 744–745.
341. Splawski I., Timothy K., Sharpe L. et al. Ca(V)1.2 calcium channel dysfunction causes a multisystem disorder including arrhythmia and autism. Cell 2004,119: 19–31.
342. Tester D J., Ackerman M J. Genetic Testing for Potentially Lethal, Highly Treatable Inherited Cardiomyopathies/Channelopathies in Clinical Practice. Circulation 2011; 123:1021–1037.
343. Westenskow P, Splawski I, Timothy KWet al. Compound Mutations. A Common Cause of Severe Long-QT yndrome. Circulation 2004; 109:1834–41.
344. Itoh H, Shimizu W, Hayashi K et al. Long QT syndrome with compound mutations is associated with a more severe phenotype: a Japanese multicenter study. Heart Rhythm 2010; 7:1411–8.
345. Schwartz PJ, Priori SG, Spazzolini C et al. Genotype-phenotype correlation in the long-QT syndrome: gene-specific triggers for life-threatening arrhythmias. Circulation 2001; 103:89–95.
346. Priori SG, Schwartz PJ, Napolitano C et al. Risk stratification in the long-QT syndrome. N Engl J Med 2003; 348:1866–1874.
347. Калинин Л.А., Макаров Л.М., Чупрова С.Н. с соавт. Диагностические возможности тестов с физической нагрузкой при синдроме удлиненного интервала QT. Вестник аритмологии. 2001; 23:28–31.
348. Ревишвили А.Ш., Проничева И.В., Заклязьминская Е.В. с соавт. Опыт применения методов днк-диагностики в лечении больных с синдромом удлиненного интервала QT. Вестник аритмологии 2005; 42:35–43.
349. Moss A, Goldenberg I. Importance of Knowing the Genotype and the Specific Mutation When Managing Patients With Long-QT. Syndrome. Circ Arrhythmia Electrophysiol 2008; 1; 219–226.
350. Nannenberg, E. A., Sijbrands, E. J. G., Dijksman et al. Mortality of Inherited Arrhythmia Syndromes / Clinical Perspective. Circulation: Cardiovascular Genetics 2012; 5(2):183–189.
351. Ackerman MJ, Tester DJ, Porter CJ. Swimming, a gene-specific arrhythmogenic trigger for inherited long QT syndrome. Mayo Clin Proc. 1999; 74:1088–1094.
352. Wilde AA, Jongbloed RJ, Doevendans PA et al. Auditory stimuli as a trigger for arrhythmic events differentiate HERG-related (LQTS2) patients from KVLQT1related patients (LQTS1). J Am Coll Cardiol. 1999; 33:327–332.
353. Moss AJ, Robinson JL, Gessman L et al. Comparison of clinical and genetic variables of cardiac events associated with loud noise versus swimming among subjects with the long QT syndrome. Am J Cardiol. 1999; 84:876–879.
354. Khositseth A, Tester DJ, Will ML et al. Identification of a common genetic substrate underlying postpartum cardiac events in congenital long QT syndrome. Heart Rhythm. 2004; 1:60–64.
355. Национальные рекомендации по допуску спортсменов с отклонениями со стороны сердечно-сосудистой системы к тренировочно-соревновательному процессу. Рац. Фарм. Кардиол. 2011; 7 (приложение №6).
356. Goldenberg I, Moss AJ. Long QT syndrome. J Am Coll Cardiol 2008; 51:2291–2300.
357. Ruan Y, Liu N, Bloise R, Napolitano C, Priori SG. Gating properties of SCN5A mutations and the response to mexiletine in long-QT syndrome type 3 patients. Circulation 2007; 116:1137–1144.
358. Ruan Y, Denegri M, Liu N et al. Trafficking defects and gating abnormalities of a novel SCN5A mutation question gene-specific therapy in long QT syndrome type 3. Circ Res 2010; 106:1374–1383.
359. Shimizu W. Clinical impact of genetic studies in lethal inherited cardiac arrhythmias. Circ J. 2008; 72:1926–1936.
360. Priori SG, Napolitano C, Schwartz PJ et al. Association of long QT syndrome loci and cardiac events among patients treated with beta-blockers. JAMA 2004; 292: 1341–1344.
361. Bhandari AK, Scheinman MM, Morady F et al. Efficacy of left cardiac sympathectomy in the treatment of patients with the long QT syndrome. Circulation, 1984; 70: 1018–1023.
362. Gollob M, Redpath C, Roberts J. «The Short QT syndrome: Proposed Diagnostic Criteria». J Am Coll Cardiol 2011; 57 (7):802–812.
363. Gaita F, Giustetto C, Bianchi F et al. Short QT Syndrome: Pharmacological Treatment. J Am Coll Cardiol 2004; 43:1494 –9.
364. Schimpf R, Wolpert C, Bianchi F et al. Congenital short QT syndrome and implantable cardioverter defibrillator treatment: inherent risk for inappropriate shock delivery. J Cardiovasc Electrophysiol 2003; 14(12):1273–7.
365. Дупляков Д.В., Глухова В.Л., Максимова С.В и соавт. Частота регистрации ЭКГ-признаков синдрома Бругада. Кардиология 2007; 47:55–9.
366. Brugada R, Campuzano O, Brugada P et al. Brugada Syndrome. 2005 Mar 31 [Updated 2012 Jan 12]. In: Pagon RA, Bird TD, Dolan CR et al., editors. GeneReviews™ [Internet]. Seattle (WA): University of Washington, Seattle; 1993. http://www.ncbi.nlm.nih.gov/books/NBK1517.
367. Заклязьминская Е.В.. Проничева И.В, Ревишвили А.Ш. и соавт. Молекулярногенетические основы синдрома Бругада. Анналы аритмологии №2, Первый Всероссийский съезд аритмологов, приложение. Июнь, 2005, с.81.
368. Priori SG, Napolitano C, Gasparini M et al. Natural history of Brugada syndromeinsights for risk stratification and management. Circulation 2002; 105:1342–1347.
369. Meregalli PG, Tan HL, Probst V et al. Type of SCN5A mutation determines clinical severity and degree of conduction slowing in loss-of-function sodium channelopathies. Heart Rhythm. 2009 Mar; 6(3):341–8.
370. Priori SG, Napolitano C, Memmi M et al. Clinical and molecular characterization of patients with catecholaminergic polymorphic ventricular tachycardia. Circulation. 2002; 106:69 –74.
371. Priori SG, Chen SR. Inherited dysfunction of sarcoplasmic reticulum Ca2+ handling and arrhythmogenesis. Circ Res.2011; 108:871–83.
372. Napolitano C, Priori SG, Bloise R. Catecholaminergic Polymorphic Ventricular Tachycardia. 2004 Oct 14 [Updated 2012 Feb 16]. In: Pagon RA, Bird TD, Dolan CR et al., editors. GeneReviews™ [Internet]. Seattle (WA): University of Washington, Seattle; 1993. http://www.ncbi.nlm.nih.gov/books/NBK1289.
373. Mohler PJ, Splawski I, Napolitano C et al. A cardiac arrhythmia syndrome caused by loss of ankyrin-B function. Proc Natl Acad Sci U S A. 2004; 101: 9137–42.
374. Дупляков Д.В., Емельяненко В.М. Синдром ранней реполяризации желудочков. Кардиология 1998; 5:64–67.
375. Klatsky AL, Oehm R, Cooper RA et al. The early repolarization normal variant electrocardiogram: correlates and consequences. Am J Med. 2003; 115(3):171–7.
376. Haissaguerre M, Derval N, Sacher F et al. Sudden Cardiac Arrest Associated with Early Repolarization N Engl J Med 2008; 358:2016–2022.
377. Rosso R, Kogan E, Belhassen B et al. J-Point Elevation in Survivors of Primary Ventricular Fibrillation and Matched Control Subjects. Incidence and Clinical Significance J Am Coll Cardiol 2008; 52:1231–8.
378. Tikkanen JT, Anttonen O, Junttila M. J. et al. Long-Term Outcome Associated with Early Repolarization on Electrocardiography. N Engl J Med 2009; 361 2529–37.
379. Moritz F. Sinner1., Wibke Reinhard2. et al. Association of Early Repolarization Pattern on ECG with Risk of Cardiac and All-Cause Mortality: A Population-Based Prospective Cohort Study (MONICA/KORA) PLoS Med. 2010; 7(7):e1000314.
380. Antzelevitch C, Yan GX. J wave syndromes. Heart Rhythm. 2010; 7(4):549–58.
381. Guilleminault C., Van Den Hoed J., Mitler M.M. In: Sleep apnea syndrome, ed by Guilleminault C., Dement W.C., Alain R. Liss., New York, 1978, P. 1.
382. Block A.J., Boysen P.G., Wynne J.W., Hunt L.A. Sleep apnea, hypopnea, and oxygen desaturation in normal subjects. N Engl J Med 1979; 300:513–517.
383. Белов А.М. Анализ процесса сна при полисомнографии. М.: Изд-во ТГТПС, 2000. 81 с.
384. Loube DI, Gay PC, Strohl KP et al. Indications for positive airway pressure treatment of adult obstructive sleep apnea patients. Chest 1999; 115:863–66.
385. Калинкин А.Л. Синдром обструктивного апноэ сна – фактор риска артериальной гипертонии. Артериальная гипертензия 2003; 2:37–41.
386. Schafer H, Koehler U, Ploch T, Peter JH. Sleep-related myocardial ischemia and sleep structure in patients with obstructive sleep apnea and coronary heart disease. Chest 1997; 111:387–93.
387. Shepard JW Jr, Garrison MW, Grither DA, Dolan GF. Relationship of ventricular ectopy to oxyhemoglobin desaturation in patients with obstructive sleep apnea. Chest 1985; 88:335–40.
388. Guilleminault C, Connolly SJ, Winkle RA. Cardiac arrhythmia and conduction disturbances during sleep in 400 patients with sleep apnea syndrome. Am J Cardiol 1983; 52:490–4.
389. Fichter J, Bauer D, Arampatzis S et al. Sleep-related breathing disorders are associated with ventricular arrhythmias in patients with an implantable cardioverterdefibrillator. Chest 2002; 122: 558–61.
390. Rossi VA, Stoewhas AC, Camen G et al. The effects of continuous positive airway pressure therapy withdrawal on cardiac repolarization: data from a randomized controlled trial. Eur Heart J 2012; doi: 10.1093/eurheartj/ehs073.
391. Gami AS, Howard DE, Olson EJ, Somers VK. Day-night pattern of sudden death in obstructive sleep apnea. N Engl J Med 2005; 352(12):1206–14.
392. Хаютин В.М., Майков Е.Б., Мазыгула Е.П., и соавт. Полная поперечная блокада сердца во время ночного апноэ. Оценка состояния нервной регуляции сердца методом спектрального анализа. Кардиология 1998; 12.
393. Свиряев Ю.В., Звартау Н.Э., Ротарь О.П., и соавт. Использования CPAPтерапии на фоне медикаментозного лечения артериальной гипертензии у больных с синдромом апноэ во сне Артериальная гипертензия 2008; 14 (3):264–269.
394. Abe H, Takahashi M, Yaegashi H et al. Efficacy of continuous positive airway pressure on arrhythmias in obstructive sleep apnea patients. Heart Vessels 2010; 25(1):63–9.
395. Doherty LS, Kiely JL, Swan V, McNicholas WT. Long-term effects of nasal continuous positive airway pressure therapy on cardiovascular outcomes in sleep apnea syndrome. Chest 2005; 127(6):2076–84.
396. Александрова C. А. Магнитнорезонансная томография с отсроченным конрастированием у пациентов с желудочковыми аритмиями. Бюллетень НЦССХ им. А.Н.Бакулева РАМН. 2011; 12 (6):223.
397. Александрова С.А., Юрпольская Л.А., Макаренко В.Н. МР-диагностика некоронарогенной патологии миокарда у детей. Сердечно-сосудистые заболевания. 2011; 3:81–88.
398. Благова О.В., Недоступ А.В., Коган Е.А. и соавт. «Идиопатические» аритмии как симптом латентной болезни сердца: опыт постановки нозологического диагноза с помощью эндомиокардиальной биопсии. Кардиология и сердечнососудистая хирургия 2010; 1:24–32.
399. Лебедев Д.С. , Татарский Р.Б. Аритмогенная дисплазия правого желудочка и роль вирусной инфекции: возможное сочетание и роль в патогенезе желудочковых аритмий. Вестник Аритмологии 2010; 58:15–20.
400. Лебедев Д.С., Татарский Р.Б. и соавт. К вопросу об этиологии идиопатических желудочковых тахиаритмий – роль кардиотропных вирусов. Тезисы доклада на IV Всероссийском съезде аритмологов, 2011 г. С. 68.
401. Носкова М.В. Этиология, топическая диагностика и результаты радиочастотной аблации некоронарогенных желудочковых аритмий. Дисс. … канд. мед. наук. М., 2004.
402. Yusuf S, Hawken S, Ounpuu S et al. Effect Of Potentially Modifiable Risk Factors Associated With Myocardial Infarction In 52 Countries (The INTERHEART Study): Case-Control Study. Lancet 2004; 364:937–52.
403. U.S. Department Of Health And Human Services. The Health Benefits Of Smoking Cessation: A Report Of The Surgeon General, DHHS Publication No. (CDC) 90-8416. Rockville, MD: U.S. Department Of Health And Human Services, Public Health Service, Centers For Disease Control And Prevention, 1990.
404. Pope CA 3rd, Eatough DJ, Gold DR et al. Acute Exposure To Environmental Tobacco Smoke And Heart Rate Variability. Environ Health Perspect 2001; 109:711–6.
405. Stein PK, Rottman JN, Kleiger RE. Effect Of 21 Mg Transdermal Nicotine Patches And Smoking Cessation On Heart Rate Variability. Am J Cardiol 1996; 77:701–5.
406. Albert CM, Chae CU, Grodstein F et al. Prospective study of sudden cardiac death among women in the United States. Circulation 2003; 107:2096–101.
407. Hallstrom AP, Cobb LA, Ray R. Smoking as a risk factor for recurrence of sudden cardiac arrest. N Engl J Med 1986; 314:271–5.
408. Beri A, Contractor T, Khasnis A, Thakur R. Statins and the reduction of sudden cardiac death: antiarrhythmic or anti-ischemic effect? Am J Cardiovasc Drugs. 2010; 10(3):155–64.
409. Levantesi G, Scarano M, Marfisi R et al. Meta-analysis of effect of statin treatment on risk of sudden death. Am J Cardiol. 2007; 100(11):1644–50.
410. Shepherd J, Cobbe SM, Ford I et al. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group. N Engl J Med 1995; 333:1301–7.
411. Ridker PM, Danielson E, Fonseca FA et al. JUPITER Study Group. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 2008; 359(21)2195–207.
412. Aarsetoey H, Aarsetoey R, Lindner T, Staines H, Harris WS, Nilsen DW. Low levels of the omega-3 index are associated with sudden cardiac arrest and remain stable in survivors in the subacute phase. Lipids. 2011; 46(2):151–61.
413. Pottala JV, Garg S, Cohen BE et al. Blood eicosapentaenoic and docosahexaenoic acids predict all-cause mortality in patients with stable coronary heart disease: the Heart and Soul study. Circ Cardiovasc Qual Outcomes. 2010 Jul; 3(4):406–12.
414. De Caterina R. n–3 Fatty Acids in Cardiovascular Disease. N Engl J Med 2011; 364:2439–50.
415. Kang JX, Leaf A. Effects of long-chain polyunsaturated fatty acids on the contraction of neonatal rat cardiac myocytes. Proc Natl Acad Sci U S A 1994; 91:9886–90.
416. Billman GE, Kang JX, Leaf A. Prevention of ischemia-induced cardiac sudden death by n-3 polyunsaturated fatty acids in dogs. Lipids 1997; 32:1161–8.
417. Zhao YT, Chen Q, Sun YX et al. Prevention of sudden cardiac death with omega-3 fatty acids in patients with coronary heart disease: a meta-analysis of randomized controlled trials. Ann Med. 2009; 41(4):301–10.
418. Corrado D., Basso C., Pavei A. et al. Trends in sudden cardiovascular death in young competitive athletes after implementation of a preparticipation screening program. JAMA. 2006; 296 (13): 1593–601.
419. Chevalier L. Sudden unexpected death in young athletes: reconsidering „hypertrophic cardiomyopathy“. Eur. J. Cardiovasc. Prev. Rehabil. 2009; 3: 23.
420. Maron B.J., Doerer J.J., Haas T.S. et al. Sudden deaths in young competitive athletes: analysis of 1866 deaths in the United States, 1980–2006. Circulation 2009; 119 (8): 1085–92.
421. Suarez-Mier M.P., Aguilera B. Causas de muerte subita asociada al deporte en Espana. Rev. Esp. Cardiol. 2002; 55(4): 347–58.
422. Van Camp S.P., Bloor C.M., Mueller F.O. et al. Nontraumatic sports death in high school and college athletes. Med. Sci. Sports Exerc. 1995; 27: 641–7.
423. Liberthson R.R. Sudden death from cardiac causes in children and young adults. N. Engl. J. Med. 1996; 334: 1039–44.
424. Земцовский Э.В. Спортивная кардиология. – Гиппократ. –1995. – 446 с.
425. Corrado D, Basso C., Schiavon M. et al. Pre-participation screening of young competitive athletes for prevention of sudden cardiac death. J. Am. Coll. Cardiol. 2008; 52: 1981–9.
426. Макаров Л.М., Солохин Ю.А. Внезапная внебольничная сердечная смерть у детей, подростков и лиц до 45 лет. Кардиология 2009; 11:33–38.
427. Cobb LA, Fahrenbruch CE, Olsufka M, Copass MK. Changing incidence of out-ofhospital ventricular fibrillation, 1980–2000. JAMA 2002; 288 (23): 3008–13.
428. Delise1 P, AlloccaG, Marras E et al. Risk stratification in individuals with the Brugada type 1 ECG pattern without previous cardiac arrest: usefulness of a combined clinical and electrophysiologic approach Euro Heart J 2011; 32:169–176.
429. Christiaans I, van Engelen K, van Langen I et al. Risk stratification for sudden cardiac death in hypertrophic cardiomyopathy: systematic review of clinical risk markers Europace (2010) 12, 313–321.
430. Maron BJ, Olivotto I, Spirito P et al. Epidemiology of Hypertrophic Cardiomyopathy – Related Death Revisited in a Large Non-Referral-Based Patient Population. Circulation 2000; 102:858–864.
431. Monnig G, Eckardt L, Wedekind E et al. Electrocardiographic risk stratification in families with congenital long QT syndrome. Euro Heart J 2006; 27:2074–2080.
432. Gollob M, Hamilton R, Hershberger RE et al. Heart Rhythm Society (HRS); European Heart Rhythm Association (EHRA). HRS/EHRA expert consensus statement on the state of genetic testing for the channelopathies and cardiomyopathies: this document was developed as a partnership between the Heart Rhythm Society (HRS) and the European Heart Rhythm Association (EHRA).Europace. 2011; 13(8):1077–109.
433. Kannel WB, Cupples LA, D’Agostino RB. Sudden death risk in overt coronary heart diseasethe Framingham Study. Am Heart J 1987; 113:799–804.
434. Kuller L, Lilienfeld A, Fisher R. Epidemiological study of sudden and unexpected deaths due to arteriosclerotic heart disease Circulation 1966; 34:1056–1068.
435. Aronow WS. Treatment of ventricular arrhythmias in older adults J Am Geriatr Soc 1995; 43:688–695.
436. Fleg JL, Kennedy HL. Cardiac arrhythmias in a healthy elderly population detection by 24-hour ambulatory electrocardiography. Chest 1982; 81:302–307.
437. Lee KL, Tai YT. Long-term low-dose amiodarone therapy in the management of ventricular and supraventricular tachyarrhythmiasefficacy and safety. Clin Cardiol 1997; 20:372–377.
438. Aronow WS, Ahn C, Mercando AD et al. Prevalence and association of ventricular tachycardia and complex ventricular arrhythmias with new coronary events in older men and women with and without cardiovascular disease J Gerontol A Biol Sci Med Sci 2002; 57:M178–M180.
439. Geelen P, Lorga FA, Primo J et al. Experience with implantable cardioverter defibrillator therapy in elderly patients Eur Heart J 1997; 18:1339–1342.
440. Panotopoulos PT, Axtell K, Anderson AJ et al. Efficacy of the implantable cardioverterdefibrillator in the elderly J Am Coll Cardiol 1997; 29:556–560.
441. Saksena S, Mathew P, Giorgberidze I et al. Implantable defibrillator therapy for the elderly Am J Geriatr Cardiol 1998; 7:11–13.
ПРИЛОЖЕНИЕ
Создание лечебно-образовательных центров по профилактике внезапной сердечной смерти
(проект)
Цель создания центров профилактики внезапной сердечной смерти
Подготовка в кратчайшие сроки высококвалифицированных медицинских кадров, способных организовать и осуществить эффективную программу профилактики внезапной сердечной смерти в лечебных учреждениях нашей страны.
Актуальность проблемы и ее решение
В России продолжается оставаться актуальной проблема смертности от сердечно-сосудистых заболеваний. При этом на долю внезапной сердечной смерти приходится около половины всех летальных исходов. Использование современных медицинских технологий, заключающихся в имплантации кардиовертеров-дефибрилляторов (ИКД), позволяет эффективно проводить профилактику внезапной сердечной смерти (ВСС). В последние годы в рамках государственного проекта «Здоровье» в различных регионах нашей страны было открыто несколько федеральных кардиохирургических центров. Тем не менее, количество проведенных имплантаций кардиовертеров-дефибрилляторов не удовлетворяет средним потребностям из расчета на 1 млн. жителей страны и значительно ниже таковых показателей по сравнению с ведущими европейскими странами и США. В России в 2011 г. планируется проведение 700 операций имплантаций кардиовертеров-дефибрилляторов (около 5 имплантаций на 1 млн. населения), тогда как в США ежегодно имплантируется более 600 кардиовертеров-дефибрилляторов на 1 млн. населения.
Главной причиной данного положения дел является не столько недостаточное финансирование данного раздела, сколько прежде всего отсутствие системного подхода к адекватной клинической оценке больных с заболеваниями сердечно-сосудистой системы, разное «понимание» больного врачами кардиологами, терапевтами, интервенционными кардиологами, кардиохирургами, посредственным уровнем постдипломного образования по данной проблематике, а также отсутствием аудита качества, оказываемой медицинской помощи, направленной на профилактику ВСС.
Среди объективных причин неудовлетворительного состояния проблемы: кардиохирургические центры в основном призваны заниматься «большими» операциями, такими как коррекция врожденных и приобретенных пороков сердца, аортокоранарное шунтирование и многое другое.
Новый подход, имеющий целью предотвращение ВСС, требует новой методологии подготовки специалистов, нового образа их клинического мышления, который возникает на стыке кардиологии, кардиохирургии, рентгенологии, анестезиологии-реаниматологии, математики и инженерии.
Стратегическое решение проблемы заключается в трех этапах ее реализации:
Первый – создании на базе кафедр кардиологии, базирующихся в многопрофильных стационарах, системы аритмологической постдипломной подготовки врачебных кадров из числа практикующих кардиологов в рамках проведения 72-часовых циклов тематического усовершенствования, 144-часовых циклов общего усовершенствования, а так же 504-часовых циклов первичной переподготовки. В ходе данных циклов предполагается освоение предмета, т.е. формирование у курсантов четкого понимания в отношении отбора пациентов-кандидатов на внезапную сердечную смерть, их последующего лечения и наблюдения.
В течение первого же года обучения возможно очное обучение 300 специалистов и заочно, с использованием интернет-трансляций проводимого цикла – 600 специалистов. Общее количество – 900–1000 человек в течение первого же года функционирования программы.
В ходе второго этапа эти врачи направляются в федеральные кардиохирургические центры по месту жительства и работы, где они осваивают методики проведения относительно простых интервенционных
процедур, а именно – имплантаций ИКД.
На третьем этапе эти специалисты организовывают и обеспечивают работу по адекватным объемам имплантаций ИКД (т.е. по профилактике внезапной сердечной смерти) на базе уже существующих лечебных учреждений (областные, городские, районные больницы – везде, где есть возможные условия) во всех регионах России.
Исходя из необходимости проведения 56.000 имплантаций кардиовертеров-дефибрилляторов (около 400 имплантаций на 1 млн. населения) каждый такой центр должен будет осуществлять и обеспечивать динамическое наблюдение и тестирование за 56 новыми имплантированными устройствами каждый год.
Этот подход, объединяющий усилия клинических специалистов различного профиля, позволит в кратчайшие сроки (до трех лет) обеспечить адекватный объем профилактики внезапной сердечной смерти во всех субъектах Российской Федерации.
Роль властей местного, регионарного и федерального уровней в реализации программы профилактики ВСС
Для лечения жизнеугрожающих аритмий, возникающих вне стационара, может быть эффективным использование наружных дефибрилляторов. Использование данного метода в общественных местах может иметь важное значение для сокращения времени от начала сердечного ареста до момента выполнения лечебной дефибрилляции. Усилия властей местного и федерального уровней могут быть направлены на формирование соответствующей законодательной базы и реализацию программ по размещению наружных дефибрилляторов в школах, спортивных учреждениях, местах с высокой плотностью скопления населения, аэропортах, вокзалах, а также на самолетах и других транспортных средствах.
